Science:科学家揭秘肺泡形成的机制
来源:生物谷 2021-03-27 17:28
如大家所知,肺泡是呼吸系统气体交换的关键性功能单位。从出生时过渡到呼吸开始,生物物理的机械力将参与新兴组织中细胞龛(Niche)的形成和塑造。
控制肺泡形成的基因组、表观基因组和生物物理线索
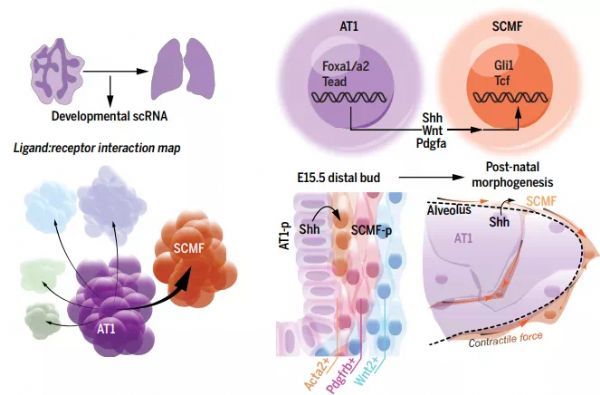
基于此,来自美国宾夕法尼亚州宾夕法尼亚大学佩雷尔曼医学院的Jarod A Zepp教授带领团队,应用多峰方法,确定了肺泡1型(AT1)上皮细胞是一个独特的信号枢纽。谱系追踪表明,AT1祖细胞在空间和时间上与能接受力的成肌纤维细胞对齐。通过单细胞染色质可及性和途径表达(SCAPE)分析,证明AT1限制性配体是成肌纤维细胞和肺泡形成所必需的。该研究成果以“Genomic, epigenomic, and biophysical cues controlling the emergence of the lung alveolus”为题在线发表在《Science》杂志上。
研究人员生成了发育中的小鼠肺部的单细胞RNA测序(scRNA-seq)地图集,其中包括跨越胚胎和出生后各个时间点的上皮,内皮和间充质区室。然后,分析了配体和受体的相互作用,并确定了肺泡1型(AT1)上皮细胞是配体表达的枢纽。这些配体的同源受体限于发育中的间充质细胞的子集。间充质祖细胞空间和转录分成ACTA2 - ,PDGFRB -或Wnt2的表达子集,并致力于在胚胎第15.5天(E15.5)之前在产后肺中生成独特的成纤维细胞。
研究人员还利用scRNA-seq和谱系示踪显示,仅在肺发育的出生后肺泡化早期存在的短暂性次生波峰成肌纤维细胞(SCMF)的祖细胞在空间和转录上与AT1细胞祖细胞对齐。与其他肺泡成纤维细胞相比,SCMF在体外具有明显更大的牵引力,这表明它们是可以重塑肺泡的功能特定的血统。
为了确定调节细胞谱系同一性的细胞间信号传导途径,研究人员检查了AT1和SCMF的单细胞染色质可及性和途径表达(SCAPE)。该研究团队确定Foxa和Tead转录因子为几种AT1衍生的配体,包括Shh和Wnt配体的上游调节剂。相反,SCMF表现出具有预定Gli1和Tcf靶基因的开放染色质,在其发育和功能中涉及Shh和Wnt途径。
参考文献
1、Zepp JA, Morley MP, Loebel C, et al. Genomic, epigenomic, and biophysical cues controlling the emergence of the lung alveolus. Science. 2021 Mar 12;371(6534):eabc3172. doi: 10.1126/science.abc3172. PMID: 33707239.
研究人员还利用scRNA-seq和谱系示踪显示,仅在肺发育的出生后肺泡化早期存在的短暂性次生波峰成肌纤维细胞(SCMF)的祖细胞在空间和转录上与AT1细胞祖细胞对齐。与其他肺泡成纤维细胞相比,SCMF在体外具有明显更大的牵引力,这表明它们是可以重塑肺泡的功能特定的血统。
为了确定调节细胞谱系同一性的细胞间信号传导途径,研究人员检查了AT1和SCMF的单细胞染色质可及性和途径表达(SCAPE)。该研究团队确定Foxa和Tead转录因子为几种AT1衍生的配体,包括Shh和Wnt配体的上游调节剂。相反,SCMF表现出具有预定Gli1和Tcf靶基因的开放染色质,在其发育和功能中涉及Shh和Wnt途径。
肺单细胞发育图谱揭示了AT1上皮细胞中配体表达的丰富特征
为了进一步测试这些途径,研究人员针对Wnt配体分泌(Wls)和Shh生成了AT1细胞特有的条件缺失。从AT1细胞中有条件地切除Shh会导致SCMF细胞丢失,并在出生后的肺中简化肺泡。
综上所述,该研究团队通过整合单细胞基因组学和沿袭追踪,确定了远端肺的发育和成熟过程中活跃的细胞间信号通路的时空格局。以前认为AT1上皮细胞主要与毛细血管内皮进行气体交换,它也是重要的配体表达节点,是肺部正常发育所必需的。这些观察结果表明,AT1细胞的生存能力对于在肺部发育过程中建立组织稳态至关重要。该研究的成像和单细胞生物物理测量分析表明,AT1相邻的间充质祖细胞占据解剖上离散的区域,并且在功能上专门塑造了复杂的肺泡结构。
综上所述,该研究团队通过整合单细胞基因组学和沿袭追踪,确定了远端肺的发育和成熟过程中活跃的细胞间信号通路的时空格局。以前认为AT1上皮细胞主要与毛细血管内皮进行气体交换,它也是重要的配体表达节点,是肺部正常发育所必需的。这些观察结果表明,AT1细胞的生存能力对于在肺部发育过程中建立组织稳态至关重要。该研究的成像和单细胞生物物理测量分析表明,AT1相邻的间充质祖细胞占据解剖上离散的区域,并且在功能上专门塑造了复杂的肺泡结构。
参考文献
1、Zepp JA, Morley MP, Loebel C, et al. Genomic, epigenomic, and biophysical cues controlling the emergence of the lung alveolus. Science. 2021 Mar 12;371(6534):eabc3172. doi: 10.1126/science.abc3172. PMID: 33707239.
2、Wang X, Wang Y, Snitow ME, et al. Expression of histone deacetylase 3 instructs alveolar type I cell differentiation by regulating a Wnt signaling niche in the lung. Dev Biol. 2016 Jun 15;414(2):161-9. doi: 10.1016/j.ydbio.2016.04.023. Epub 2016 Apr 30. PMID: 27141870; PMCID: PMC4975046.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->