新冠疫情:302万!赛诺菲/再生元IL-6受体抑制剂Kevzara治疗(危)重症患者数据不理想,修改方案!
来源:本站原创 2020-04-28 04:05
2020年04月27日讯 /生物谷BIOON/ --目前,国外新冠肺炎疫情仍在迅速蔓延。根据百度《新型冠状病毒肺炎疫情实时大数据报告》,截止2020年04月27日23时,全球累计确诊超过302万例,国外累计确诊超过294万例、死亡超过20.3万例。美国累计确诊98.8万例,死亡5.5万例。新冠疫情形势空前严峻,各国政府正在紧急授权,将有潜力的药物/疗法用于重

2020年04月27日讯 /生物谷BIOON/ --目前,国外新冠肺炎疫情仍在迅速蔓延。根据百度《新型冠状病毒肺炎疫情实时大数据报告》,截止2020年04月27日23时,全球累计确诊超过302万例,国外累计确诊超过294万例、死亡超过20.3万例。美国累计确诊98.8万例,死亡5.5万例。
新冠疫情形势空前严峻,各国政府正在紧急授权,将有潜力的药物/疗法用于重症新型冠状病毒肺炎(COVID-19)的治疗,其中包括抗病毒药物、抗疟疾药物、抗炎药物、康复期血浆、血液净化技术、干细胞疗法等。
科学家有初步证据表明,在COVID-19危重症患者中,IL-6在驱动导致急性呼吸窘迫综合征(ARDS)的炎症免疫反应中起着关键作用。最初的非同行评审结果来自一个单臂、21例中国患者的试验发现,COVID-19患者在接受另一种IL-6受体抗体tocilizumab(托珠单抗,雅美罗®)后的几天内发烧迅速减少,75%的患者(20人中有15人)减少补充氧气需要。基于这些结果,今年3月初,中国国家卫健委更新COVID-19治疗指南,并批准使用tolicizumab(托珠单抗,雅美罗®)治疗重症或危重症患者。

基于上述证据,今年3月中旬,赛诺菲(Sanofi)和再生元(Regeneron)宣布启动抗炎药Kevzara(sarilumab)治疗新型冠状病毒肺炎(COVID-19)住院患者的全球性II/III期临床试验。Kevzara是一种全人单克隆抗体,通过结合和阻断IL-6受体(IL-6R)抑制IL-6通路。根据前述证据,IL-6可能在COVID-19重症或危重症患者肺部过度活跃的炎症反应中起作用。因此,Kevzara有潜力为COVID-19重症或危重症患者带来治疗受益。
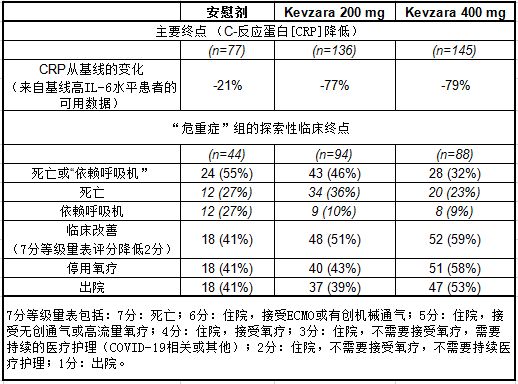
近日,赛诺菲和再生元公布了这项II/III期临床试验的II期部分的初步结果,该试验评估了Kevzara用于住院患者治疗由COVID-19引起的“重症(severe)”或“危重症(critical)”呼吸道疾病。在独立数据监测委员会(IDMC)对所有可用的II期和III期数据进行审查后,该试验将立即进行修订,停止Kevzara低剂量(200mg)、停止入组“重症”患者,III期试验将修改为只入组“危重症”患者,所有新入组患者接受Kevzara高剂量(400mg)或安慰剂。
试验的随机II期部分比较了静脉注射Kevzara高剂量(400毫克)、低剂量(200毫克)和安慰剂的情况,评估了457名住院患者,这些患者在基线时被分类为有“重症”疾病(28%的患者)、“危重症”疾病(49%的患者)或“多系统器官功能障碍”(23%的患者)。如果患者需要补氧但不是机械通气或高流量吸氧,则被归类为“重症”;如果患者需要机械通气或高流量吸氧,或需要在重症监护室进行治疗,则被归类为“危重症”。
对试验II期部分的初步分析表明,Kevzara迅速降低了C-反应蛋白(CRP),这是炎症的关键标志,达到了主要终点(见下表)。所有治疗组的IL-6基线水平均升高,与“重症”患者相比,“危重症”患者的IL-6水平更高。此外,在COVID-19患者中使用Kevzara没有观察到新的安全信号。
II期试验的临床结果分析是探索性的,并预先指定以“重症”组和“危重症”组为重点。在初步II期分析中,Kevzara在“重症”和“危重症”两个组的合并临床结果上与安慰剂相比没有显著的益处。然而,“重症”组的大多数结果呈负趋势,而“危重症”组的所有结果呈正趋势(见下表)。在IDMC审查之后,赛诺菲和再生元审查了中止的“重症”组数据,数据显示II期试验(n=126)中的负面趋势在III期试验(n=276)中没有再现,并且这些临床结果在Kevzara组和安慰剂组之间是平衡的。“严重”组的预后好于基于前面报告的预期,而不考虑治疗分配:例如,在II期试验,约80%的患者出院,10%的患者死亡,10%的患者仍然住院。
再生元联合创始人、总裁兼首席科学官George D. Yancopoulos博士表示:“即使在大流行的背景下,在适当规模的试验中获得对照数据,以提供必要的证据为最佳医疗护理提供信息,也是至关重要的,也是可能的。在COVID-19危机中,与Kevzara和其他重构用途的药物有关的新证据突出了利用小规模、非对照研究对现有药物应对新病毒威胁作出决定的挑战。我们等待正在进行的III期试验的结果,以了解更多关于COVID-19的信息,并更好地了解一些患者是否可以从Kevzara治疗中获益。此外,迫切需要专门针对这种病毒的定制方法。为此,再生元正在迅速推进我们的靶向抗SARS-CoV-2抗体鸡尾酒,我们计划在6月份开始临床试验。”
赛诺菲全球研发主管John Reed医学博士表示:“在赛诺菲,我们致力于帮助抗击全球COVID-19大流行。随着我们快速遵循科学来更好地理解这种疾病并探索如何最好地治疗患者,来自这项随机临床试验的这些初步结果为医生提供了关于Kevzara治疗COVID-19患者潜力方面非常急需的见解和信息。尽管我们对使用Kevzara治疗COVID-19的评估仍然是一种研究方法,但赛诺菲仍然站在对抗这种疾病的多个倡议的前沿,包括研究其他潜在的治疗方案,开发可大规模生产的候选疫苗,以及潜在的合作开发一中基于智能手机的SARS-CoV-2自我测试解决方案。”
目前,正在进行的III期试验部分将继续入组患者,目前“危重症”组已入组了超过600例患者。赛诺菲和再生元将继续对III试验进行中部分保持封盲,预计将在6月之前报告结果。
此外,双方也正在美国以外的国家开展第二项III期试验,该试验目前正在意大利、西班牙、德国、法国、加拿大、俄罗斯、以色列、日本入组约400例COVID-19住院患者。这项试验的初步结果将在2020年第三季度公布。美国试验的结果将立即与IDMC分享,并将考虑对美国以外的试验进行类似修改。(生物谷Bioon.com)
原文出处:Regeneron and Sanofi Provide Update on U.S. Phase 2/3 Adaptive-Designed Trial of Kevzara® (sarilumab) in Hospitalized COVID-19 Patients
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


