《科学》:“致病”蛋白如何帮助记忆
来源:学术经纬 2020-03-18 12:57
顶尖学术期刊《科学》的最新一期上,刊登了一项有关“淀粉样蛋白”的研究。美国Stowers研究所(Stowers Institute for Medical Research)的科学家与合作者首次以原子分辨率描述了大脑神经细胞中一种淀粉样蛋白的结构,让我们对这类常与神经疾病联系在一起的蛋白有了新的认识。通常说到淀粉样蛋白,大家通常会想到各种神经退变
顶尖学术期刊《科学》的最新一期上,刊登了一项有关“淀粉样蛋白”的研究。美国Stowers研究所(Stowers Institute for Medical Research)的科学家与合作者首次以原子分辨率描述了大脑神经细胞中一种淀粉样蛋白的结构,让我们对这类常与神经疾病联系在一起的蛋白有了新的认识。
通常说到淀粉样蛋白,大家通常会想到各种神经退变有关的疾病,比如阿尔茨海默病,还有帕金森病、亨廷顿病和克雅病等。所谓的“淀粉样”,指的是原本可溶的蛋白异常地形成稳定的、不可溶的沉积物,破坏神经组织。
“过去我们认为,淀粉样蛋白的产生通常是由于某种原因蛋白质变性或错误折叠,是一种不受控制的随机过程。”Kausik Si教授说。
然而,Kausik Si教授认为,对淀粉样蛋白的主流认识可能存在误解。Kausik Si教授师从神经生物学家、因记忆研究荣获诺贝尔生理学或医学奖的Eric Kandel教授。在2003年,他们研究加利福尼亚海兔(Aplysia californica)——记忆研究的经典模式生物时,有了惊人的发现。
在神经系统相对简单的海兔中,竟存在有生理功能的淀粉样蛋白。这种名为CPEB的蛋白与RNA结合,调控RNA翻译为蛋白质的过程,当它们聚合形成的淀粉样蛋白时,帮助海兔维持长期记忆。
后续在果蝇、小鼠等神经系统更复杂的动物中,研究人员发现,这种蛋白(在果蝇中的版本称为Orb2)也会发生自我聚合。
具体来说,CPEB/Orb2在脑中有两种结构形态,分别执行不同的功能,对于形成持久的记忆非常重要。主要形态是可溶的单体,在神经连接处(也就是突触)抑制翻译过程;而当记忆形成时,这些单体会自我组装成有生物化学活性的淀粉样蛋白,促进突触的蛋白质翻译。
基于这些发现,Kausik Si教授认为,淀粉样蛋白并不只是病理性的“坏”蛋白,而是“可以在特定时间、特定细胞中以特定形式形成”。不过,尽管他们猜测淀粉样蛋白的状态对于Orb2来说可能很重要,但在动物的神经细胞内,“好”的淀粉样蛋白是否真正存在,需要“眼见为实”。在此次研究中,科学家们决定一看究竟。
为看清具有生化活性的蛋白结构,研究人员没有像通常那样从细菌中提取重组表达的蛋白,而是从天然的来源得到内源性蛋白。“原始环境,也就是神经系统,对于保持蛋白质的活性构象非常重要。”第一作者Ruben Hervas博士介绍。为此,他们从大约300万只果蝇的大脑中分离并纯化出足够的Orb蛋白。
艰巨的工作获得了回报!从纯化的蛋白样本中,他们确认Orb2能以单体、低聚体以及淀粉样细丝形式存在,并且验证不同形式对蛋白翻译起着抑制或激活的不同作用。
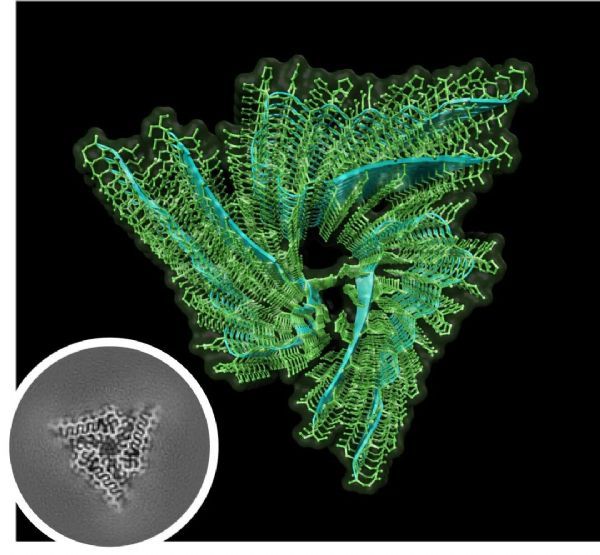
利用冷冻电镜(cryo-EM)技术,研究人员解开了内源性Orb2的结构,分辨率达到2.6埃。高分辨率的蛋白结构让我们看到,内源性Orb2形成了约75纳米长的三重螺旋对称淀粉样蛋白丝,31个氨基酸组成的原纤维核心以亲水性界面相互交叉堆积。而这一点与致病淀粉样蛋白的疏水性核心存在明显差别。
通常淀粉样蛋白与记忆丧失有关,而这种神经元蛋白的淀粉样蛋白帮助记忆形成,研究者猜测,或许就与这种结构特性有关。该研究在结论部分指出,“Orb2的亲水性核心表明,一些神经元淀粉样蛋白可以作为稳定、可调节的记忆底物”。
接下来,研究人员打算确认,在人脑中是否同样有这种具备正常功能的淀粉样蛋白,以及它们对记忆的形成究竟起什么作用。或许我们对淀粉样蛋白“损害神经”的老观念会改变,也会对记忆如何形成有新的认识。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。