Nature:为什么新冠病毒在人群中如此容易传播?
来源:本站原创 2020-03-10 08:36
研究人员已经确定了可能使这种病原体比SARS病毒更具传染性的微观特征,并可作为药物靶标。随着全球冠状病毒感染人数接近10万人,研究人员正在竞相了解是什么让它如此容易地传播。一些基因和结构分析已经确定了这种病毒的一个关键特征--表面的一种蛋白质--这也许可以解释为什么它如此容易感染人类细胞。其他研究小组正在研究新冠状病毒进入人体组织的途径--细胞膜上的受体。细
2020年3月10日讯 /生物谷BIOON /——研究人员已经确定了可能使这种病原体比SARS病毒更具传染性的微观特征,并可作为药物靶标。
随着全球冠状病毒感染人数接近10万人,研究人员正在竞相了解是什么让它如此容易地传播。
一些基因和结构分析已经确定了这种病毒的一个关键特征--表面的一种蛋白质--这也许可以解释为什么它如此容易感染人类细胞。
其他研究小组正在研究新冠状病毒进入人体组织的途径--细胞膜上的受体。细胞受体和病毒蛋白都为药物阻断病原体提供了潜在的靶点,但研究人员说,现在还不能确定。
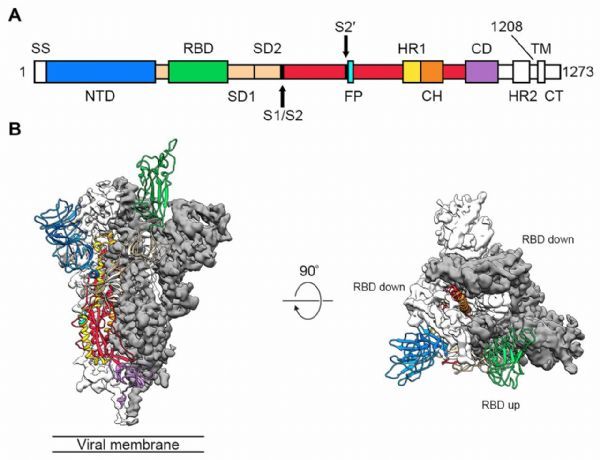
图片来源:Science
"了解病毒的传播是控制和未来预防的关键,"西雅图华盛顿大学的结构病毒学家David Veesler说,他于2月20日在生物医学预印服务器bioRxiv上发布了他的团队关于病毒蛋白的发现。
这种新病毒的传播比导致严重急性呼吸系统综合症(SARS)(也是一种冠状病毒)的病毒要容易得多,感染的人数是感染SARS的十倍多。
刺状的入侵者
为了感染细胞,冠状病毒使用一种"刺状"蛋白质(S蛋白)与细胞膜结合,这一过程被特定的细胞酶激活。对这种新型冠状病毒的基因组分析显示,它的峰值蛋白不同于那些近亲,并表明这种蛋白上有一个位点是由一种叫做弗林蛋白酶的宿主细胞酶激活的。
华中科技大学结构生物学家Li Hua表示,这是意义重大,因为弗林蛋白酶在大量的人体组织,包括肺、肝脏和小肠中都有,这意味着病毒有可能攻击多个器官。李说,这一发现可以解释在冠状病毒感染者身上观察到的一些症状,比如肝功能衰竭。2月23日,李与人合着了一份病毒遗传分析报告,并发布在ChinaXiv的预印服务器上。他说,SARS和其他与新病毒同属的冠状病毒没有弗林蛋白酶激活位点。
位于纽约的康奈尔大学病毒学家Gary Whittaker表示,弗林蛋白酶激活位点"使病毒进入细胞的方式与SARS非常不同,可能会影响病毒的稳定性,从而影响传播"。他的团队于2月18日发表了另一篇关于bioRxiv上冠状病毒峰值蛋白的结构分析。
其他几个研究小组也确认了这个激活位点,认为它可能使病毒能够在人类之间有效传播。他们指出,这些位点也存在于其他容易在人与人之间传播的病毒中,包括严重的流感病毒株。在这些病毒上,激活位点是在一种叫做血凝素的蛋白质上,而不是在刺突蛋白上。
呼吁谨慎对待
但一些研究人员对夸大激活位点在帮助冠状病毒更容易传播方面的作用持谨慎态度。"我们不知道这是否会是个大问题,"德克萨斯大学奥斯汀分校的结构生物学家Jason McLellan说,他与人合着了另一篇关于冠状病毒的结构分析,并于2月20日发表在《Science》杂志上。
图片来源:NIH
其他科学家对将流感病毒的激活位点与新型冠状病毒的激活位点进行比较持谨慎态度。澳大利亚悉尼新南威尔士大学(University of New South Wales)的病毒学家Peter White说,流感病毒表面的血凝素蛋白与冠状病毒的峰值蛋白既不相似,也不相关。
芝加哥伊利诺伊大学(University of Illinois)病毒学家Rong Lijun说,导致有记录以来最致命的流感大流行(1918年西班牙流感大流行)的流感病毒甚至没有弗林蛋白酶激活位点。
Whittaker说,需要在细胞或动物模型中进行研究,以测试激活位点的功能。他说:"冠状病毒是不可预测的,好的假设往往被证明是错误的。"他的团队目前正在测试移除或修改该位点如何影响S蛋白的功能。
药物靶点
李的研究小组也在研究能够阻止弗林蛋白酶的分子,这可能是一种可能的治疗方法。但是由于疫情的爆发,他们的进展缓慢。李住在校园里,目前是唯一可以进入团队实验室的成员。
McLellan在德克萨斯州的研究小组发现了另一个特征,可以解释为什么这种新型冠状病毒如此成功地感染人类细胞。他们的实验表明,这种S蛋白与人体细胞上的一种受体--血管紧张素转换酶2 (ACE2)--结合的紧密程度至少是SARS病毒中S蛋白的十倍。Veesler的团队也发现了这一点,这表明受体是疫苗或治疗的另一个潜在目标。例如,一种阻断受体的药物可能会使冠状病毒更难进入细胞。(生物谷Bioon.com)
参考资料:
【1】Smriti Mallapaty. Why does the coronavirus spread so easily between people? Nature. 2020. DOI:10.1038/d41586-020-00660-x
【2】Walls, A. C. et al. Structure, function and antigenicity of the SARS-CoV-2 spike glycoprotein. Preprint at bioRxiv https://doi.org/10.1101/2020.02.19.956581 (2020).
【3】Li, H. et al. Furin, a potential therapeutic target for COVID-19. Preprint at ChinaXiv https://doi.org/10.12074/202002.00062 (2020).
【4】Jaimes, J. A et al. Structural modeling of 2019-novel coronavirus (nCoV) spike protein reveals a proteolytically-sensitive activation loop as a distinguishing feature compared to SARS-CoV and related SARS-like coronaviruses. Preprint at bioRxiv https://doi.org/10.1101/2020.02.10.942185 (2020).
【5】Coutard, B. et al. The spike glycoprotein of the new coronavirus 2019-nCoV contains a furin-like cleavage site absent in CoV of the same clade. Antiviral Res. https://doi.org/10.1016/j.antiviral.2020.104742 (2020).
【6】Wrapp, D. et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science https://doi.org/10.1126/science.abb2507 (2020).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。