Sci Adv:新方法可改进癌症放疗效果
来源:本站原创 2020-01-24 02:43
关于癌症生物学的知识的日益增长促进了靶向杀伤癌细胞的许多治疗策略的诞生。其中包括一种叫做“硼中子俘获疗法(BNCT)”的放射疗法,该方法将硼导入癌细胞中并将其暴露于中子射线下,使其发生核裂变,从而杀死癌细胞。如果临床医生可以确保硼仅存在于癌细胞中,那么他们可以特异性地仅破坏癌细胞而不损害人体的正常细胞。
2020年1月24日 讯 /生物谷BIOON/ --关于癌症生物学的知识的日益增长促进了靶向杀伤癌细胞的许多治疗策略的诞生。其中包括一种叫做“硼中子俘获疗法(BNCT)”的放射疗法,该方法将硼导入癌细胞中并将其暴露于中子射线下,使其发生核裂变,从而杀死癌细胞。如果临床医生可以确保硼仅存在于癌细胞中,那么他们可以特异性地仅破坏癌细胞而不损害人体的正常细胞。
东京理工大学,京都大学和纳米医学创新中心(iCONM)的科学家通过将BPA与聚乙烯醇结合生产PVA-BPA复合物,从而改善了目前的BNCT治疗效果,该复合物具有更长的在细胞中保留的时间,增强了其的杀癌潜力。
(图片来源:东京理工大学)
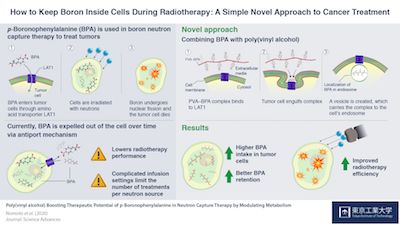
科学家首先发现了使用对-硼烷苯丙氨酸(BPA)诱导这种选择性摄取的方法。 BPA是具有苯丙氨酸结构的含硼化合物。区别癌细胞与正常细胞的因素之一是称为LAT1氨基酸转运蛋白的特殊结构的过多,该结构识别并允许将苯丙氨酸转运到细胞中。因此,当BPA存在于癌细胞外部时,细胞表面的这些转运蛋白使其进入癌细胞,从而成功实现BNCT的治疗目的。因此,BPA一直被认为是BNCT最好的药物。
但是,BPA有一个缺点:一旦癌细胞中的BPA水平升高,就会通过“反转运”机制将其排出,这使BNCT具有某种程度的局限性。因此,需要患者连续输注BPA 30至60分钟,以维持细胞内所需的量以使反应成功。
为了克服这些缺点,东京工业大学,京都大学和西山信弘教授领导的iCONM的科学家决定探索将硼保留在癌细胞中更长时间的其他方法。 西山教授说:“我们假设,调节细胞内BPA的存在将确保它们不会通过反向机制被送出胞外。”
为此,他们将聚乙烯醇(PVA)和BPA的化合物混合在一起以形成PVA-BPA复合物,并观察了该化合物在癌细胞中的停留。他们发现添加PVA不会影响BPA的苯丙氨酸结构,从而使LAT1转运蛋白能够识别PVA-BPA复合物。但是,由于这种复合物太大而无法通过转运蛋白,因此LAT1转运蛋白将复合物吞入胞内体中,然后将其转运到细胞中。由于BPA安全地存在于胞内体中,因此癌细胞无法通过反转运机制将其立即排出,这确保了硼在细胞中保留的时间足够长,可以有效杀死癌细胞。作者动物模型中测试了该方法,发现其增强了BNCT的抗癌活性。
相关结果发表在最近的《Science Advance》杂志上。(生物谷Bioon.com)
原始出处:"Poly(vinyl alcohol) boosting therapeutic potential of p-boronophenylalanine in neutron capture therapy by modulating metabolism" Science Advances (2020). DOI: 10.1126/sciadv.aaz1722 ,
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


