深度剖析!特定基因的突变如何对血液癌症的发生产生重要影响?
来源:本站原创 2019-07-23 13:15
2019年7月23日 讯 /生物谷BIOON/ --在血液中循环的细胞具有多种功能,在成年人机体中,其来自于骨髓中的祖细胞,祖细胞中DNA序列的突变会引发血细胞发育的改变,有时候会导致癌症发生;由于技术限制,科学家们在阐明祖细胞突变对血细胞发育的影响上面对一定的挑战,近日,研究者Nam等人在Nature杂志上发表文章指出,他们开发了一种新方法能够检测单一血液祖细胞中的突变并测定细胞中基因的表达水平
2019年7月23日 讯 /生物谷BIOON/ --在血液中循环的细胞具有多种功能,在成年人机体中,其来自于骨髓中的祖细胞,祖细胞中DNA序列的突变会引发血细胞发育的改变,有时候会导致癌症发生;由于技术限制,科学家们在阐明祖细胞突变对血细胞发育的影响上面对一定的挑战,近日,研究者Nam等人在Nature杂志上发表文章指出,他们开发了一种新方法能够检测单一血液祖细胞中的突变并测定细胞中基因的表达水平,同时研究者还能用该技术来分析携带或不携带癌症相关基因突变的祖细胞混合物,研究者发现,携带相同突变的祖细胞会产生具有不同基因表达特性的细胞。

图片来源:courses.lumenlearning.com
造血作用(haematopoiesis)即祖细胞形成成熟血细胞的过程,该过程会被严格调控,祖细胞决定成为哪种类型的细胞通常是由其周围环境所接接收到的信号所决定的,然而这些祖细胞中有时候会发生突变,从而导致信号传输被阻断、过度放大或被忽略,这会引发特性类型细胞富集或耗尽,在某些情况下就会产生癌变克隆,理解祖细胞中突变所引发不同细胞类型产生的改变对于研究人员而言至关重要。
阐明祖细胞突变影响其基因表达及细胞身份和功能的分子机制对于研究人员而言具有一定的挑战,这主要是因为突变的细胞可能是罕见的,而且其通常并不表达用来与非突变细胞进行区分的分子标记;在单一细胞中能够检测遗传差异并测定基因表达的策略通常能将来自免疫学细胞混合体的细胞分配给其原始人类供体,同时也能帮助研究接受干细胞移植的血液癌症患者机体中宿主和供体细胞所发生的改变,然而组合性方法或许无法广泛用来分析癌症相关基因突变对血细胞发育过程中所产生的影响效应。
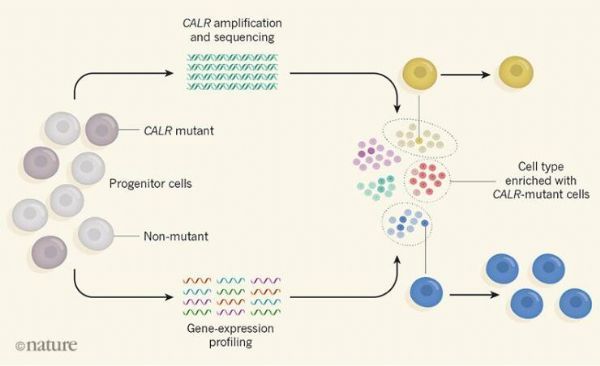
研究者Nam等人设计了一种名为转录组基因型分型(GoT,genotyping of transcriptomes),其能将当前分析基因表达特性的平台与进行放大特异性遗传序列检测突变的技术相结合,研究人员能利用这种新技术对5名血液患者(因CALR基因突变所引发,主要特点为血小板过量产生)骨髓中数千个祖细胞样本进行分析,GoT能够帮助研究者确定哪些样本细胞中携带有CALR突变。
研究人员利用了一种统计学分析手段,根据细胞基因表达的特性将样本祖细胞分为不同类型的细胞,所有已经鉴别的细胞类型都包含携带和不携带CALR突变的细胞;然而,CALR突变细胞更有可能会遵循特定的分化通路从而转变为特性类型的血细胞;此外研究者Nam及其同事还发现,当在祖细胞中时,突变的效应或许只有在细胞分化的后期阶段才会被注意到,CALR突变细胞的子代要比非突变细胞的子代更为丰富,且具有明显的基因表达谱,使用标准技术或许无法观察到这种现象,这就再次证实了这种新方法的重要价值。
图片来源:Nam et al.
尽管GoT技术具有一定的局限性,但可以通过使其适应新的单细胞工作流来解决这些问题,首先,GoT需要得到突变基因或一系列潜在突变基因的身份;比如,研究者能利用多路复用分析版本来同时靶向遗传序列的多个预先指定的部分进行3个基因的检测,如果没有特定的突变,基因组中的基因或区域就会被指定用于分析(比如,基于与疾病进展的关联),从理论上来讲,多路复用分析能够覆盖更大的基因检测范围,然而这或许并不划算。
其次,相比基因末端而言,GoT技术无法有效检测基因中段附近所发生的突变,而解决该问题的一种方法就是利用低通量的平台来对单一细胞中长链的RNA转录物进行分析,从理论上来讲,这种方法能够检测基因RNA编码部分中任意位置的突变;研究者Nam就开发了一种名为新型纳米孔测序法(nanopore sequencing)的新方法,在该方法下,全长的转录物会通过一个微小的孔进行测序,而且其还与高通量的平台兼容。第三,GoT并不能检测未被转录的遗传序列中的突变,但可能会影响基因的表达,研究者或能利用GoT技术和另外一种技术进行结合来调查这种序列,另外一种技术能够测定细胞中特定DNA序列与酶类的可接近特性。
在最近发表的一篇研究报告中,研究人员利用了一种不同的高通量技术来完成类似的靶向放大策略,从而来研究血液癌症(部分是因为祖细胞突变导致造血功能中断引发);这项研究中,研究人员仅在恶性的祖细胞中鉴别出了一类能够共表达的基因群,同时研究者还描述了一种机器学习方法,其能利用基因表达数据将恶性细胞与非恶性细胞进行有效区分(甚至并不使用预先设定的基因测序信息)。那么同样的机器学习时候段是否能够利用研究者Nam所得到的基因表达数据来将恶性与非恶性细胞进行区分,这或许是一个非常有趣的问题,从单个细胞中获取基因测序的信息仍然比评估基因表达更具难度和挑战性,而且仅根据单个细胞基因表达来预测恶性肿瘤的方法或许具有广泛的临床意义。
从理论上来讲,GoT和类似的方法能够用来研究任何癌症类型,其能够精确确定已知基因突变对下游细胞发育状态的影响,并能够确定是否特定的突变就足以诱发癌症,反过来,这些发现也会帮助研究人员阐明癌细胞克隆谱系的进化机制。(生物谷Bioon.com)
参考资料:
【1】Anna S. Nam, Kyu-Tae Kim, Ronan Chaligne, et al. Somatic mutations and cell identity linked by Genotyping of Transcriptomes, Nature volume 571, pages355–360 (2019) doi:10.1038/s41586-019-1367-0
【2】Kang HM, Subramaniam M, Targ S, et al. Multiplexed droplet single-cell RNA-sequencing using natural genetic variation. Nat Biotechnol. 2018 Jan;36(1):89-94. doi: 10.1038/nbt.4042
【3】Zheng GX, Terry JM, Belgrader P, et al. Massively parallel digital transcriptional profiling of single cells. Nat Commun. 2017 Jan 16;8:14049. doi: 10.1038/ncomms14049.
【4】Ishaan Gupta, Paul G Collier, Bettina Haase, et al. Single-cell isoform RNA sequencing characterizes isoforms in thousands of cerebellar cells Nature Biotechnology volume 36, pages 1197–1202 (2018) doi:10.1038/nbt.4259
【5】Macaulay IC, Haerty W, Kumar P, et al. G&T-seq: parallel sequencing of single-cell genomes and transcriptomes. Nat Methods. 2015 Jun;12(6):519-22. doi: 10.1038/nmeth.3370
【6】Buenrostro JD, Wu B, Litzenburger UM, et al. Single-cell chromatin accessibility reveals principles of regulatory variation. Nature. 2015 Jul 23;523(7561):486-90. doi: 10.1038/nature14590
【7】van Galen P, Hovestadt V, Wadsworth Ii MH, et al. Single-Cell RNA-Seq Reveals AML Hierarchies Relevant to Disease Progression and Immunity. Cell. 2019 Mar 7;176(6):1265-1281.e24. doi: 10.1016/j.cell.2019.01.031
【8】Siddharth Raju & Chun Jimmie Ye. How mutations express themselves in blood-cell production
Nature 571, 329-330 (2019) doi:10.1038/d41586-019-02028-2
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。