信达生物与驯鹿医疗联合开发的BCMA CAR-T临床数据亮相ASCO和EHA
来源:美通社 2019-06-18 20:43
信达生物制药(香港联交所股票代码:01801),是一家致力于研发、生产和销售用于治疗肿瘤、自身免疫疾病等重大疾病的创新药物的生物制药公司。今天宣布:信达生物制药与南京驯鹿医疗技术有限公司联合开发的全人源BCMA CAR-T细胞(研发代号:CT103A),在刚结束的第24届欧洲血液学协会年会(EHA)和第55届美国临床肿瘤学会年会(ASCO)上,分别以口头报告和壁报展示的形式对外公布一项由研究者发起
信达生物制药(香港联交所股票代码:01801),是一家致力于研发、生产和销售用于治疗肿瘤、自身免疫疾病等重大疾病的创新药物的生物制药公司。今天宣布:信达生物制药与南京驯鹿医疗技术有限公司联合开发的全人源BCMA CAR-T细胞(研发代号:CT103A),在刚结束的第24届欧洲血液学协会年会(EHA)和第55届美国临床肿瘤学会年会(ASCO)上,分别以口头报告和壁报展示的形式对外公布一项由研究者发起、在华中科技大学同济医学院附属同济医院开展的临床试验研究数据(壁报摘要# 8013,美国中部时间6月4日;口头发言摘要#S827,中欧夏令时间 6月15日(周六)下午12:35 PM – 12:45 PM)。
信达生物制药与南京驯鹿医疗技术有限公司联合开发的全人源BCMA CAR-T细胞,在刚结束的EHA和ASCO上,分别以口头报告和壁报展示的形式对外公布一项由研究者发起、在华中科技大学同济医学院附属同济医院开展的临床试验研究数据。
CT103A是信达生物与驯鹿医疗联合开发的抗BCMA CAR-T细胞注射液,拟用于治疗复发或难治性多发性骨髓瘤。在ASCO和EHA年会上,CT103A展示了积极的数据:客观缓解率(ORR)为100%, 并且CAR-T在体内具有很强的持久性和扩增能力,将有望为复发/难治性多发性骨髓瘤(RRMM)患者提供一个全新的治疗手段,特别是对曾接受鼠源单链抗体CAR-T治疗复发的患者也表现出良好的治疗效果。
多发性骨髓瘤(multiple myeloma,MM)是一种克隆性浆细胞异常增殖的恶性血液系统肿瘤,迄今在医学上尚无法治愈。在很多国家,多发性骨髓瘤是第二常见的血液肿瘤。据美国癌症协会估计,2019年美国将会有32,110例新增确诊案例。2018年欧洲有超过48,200位患者被诊断出多发性骨髓瘤,其中的40%为中高危多发性骨髓瘤患者,其中位存活时间不超过5年。
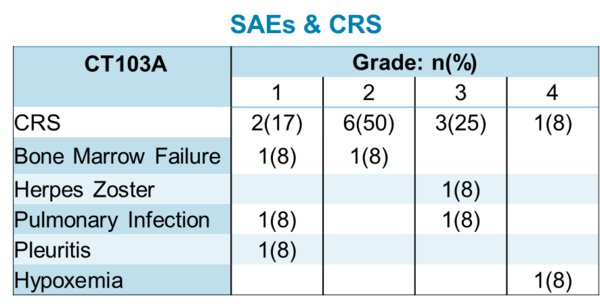
截至2019年5月22日,在11名接受CT103A治疗的可评估受试者中,客观缓解率(ORR)达100%(7例CR、4例VGPR),最长随访时间8个月。CAR-T在患者体内表现出很好的扩增能力和持久性。所有的患者均接受了CRS评估,CRS在2-5天内发生(中位数:2.6天),并在14天内消退。中低剂量组大部分CRS为一到二级,高剂量组观察到更高级别的CRS,CRS常规使用托珠单抗和类固醇治疗。值得关注的是,11例可评估患者中包括4例先前接受过鼠源抗BCMA CAR-T治疗后复发的患者,其中3例完全缓解(CR),1例非常好的部分缓解(VGPR)。

图1:临床数据 -- 临床数据图显示客观缓解率(ORR) 100%,完全缓解(CR) 64%,非常好的部分缓解(VGPR) 36%。加粗和下划线表明患者先前接受过CAR-T治疗后复发。(数据截至: 05/22/2019)
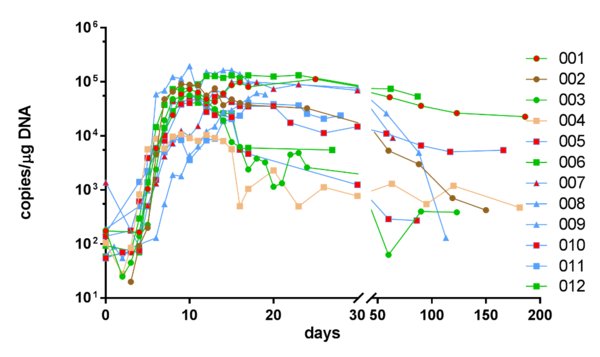
图2:CT103A扩增和持久性 -- CAR-T回输后的扩增和持久性。线的颜色表示患者14天的疗效评价; 剂量为1(圆形)、3(正方形)、6(三角形)x106细胞/公斤;红色填充符号表示患者在先前CAR-T治疗中失败。(数据截至: 05/22/2019)
“复发/难治性多发性骨髓瘤(RRMM)与预后不良有关,”华中科技大学同济医学院附属同济医院李春蕊主任表示。“许多接受鼠源单链抗体(scFv)CAR-T治疗的患者已经出现复发,由于免疫原性无法进行再治疗。CT103A具有全人源BCMA scFv,不仅首次治疗具有突出疗效,而且也为这些复发患者提供了一个有效的解决方案。这些数据表明,未来临床试验时不应排除该部分受试者。”
关于复发/难治性多发性骨髓瘤
对于初治的多发性骨髓瘤患者,常用的一线治疗药物包括蛋白酶体抑制剂、免疫调节类药物及烷化剂类药物。对于大多数的患者,常用的一线治疗可以使患者的病情稳定3-5年,但也有少部分患者在初治时表现为原发耐药,病情不能得到有效控制。复发患者为:经治疗疾病达到完全缓解后,疾病再次出现的患者。难治的患者表现为:原发耐药患者;经过标准的一线治疗后,疾病不能达到缓解或达到微小缓解后60天内出现疾病进展的患者。对于治疗有效的大多数初治患者,在经过3-5年的疾病稳定期后也将不可避免的进入复发、难治阶段,对于这部分患者现有的二线治疗总体有效率大概在40至70%,且缓解时间短。
关于 CT103A
CT103A是由信达生物制药和驯鹿医疗联合开发的一种全人源BCMA CAR-T创新产品。既往研究表明,接受高剂量BCMA靶向CAR-T细胞治疗的复发/难治性多发性骨髓瘤(RRMM)患者可能获得更好的缓解,但不良事件更严重。此外,一旦病情再次恶化,CAR-T细胞的再回输是无效的。CT103A的开发有望解决这一难题。它以慢病毒为基因载体转染自体T细胞,CAR包含全人源scFv、CD8a 铰链和跨膜、4-1BB共刺激和CD3z激活结构域。基于严格的筛选,通过全面的体内外功能评价,CT103A具有良好的临床应用前景,并有突出的持久性。
关于驯鹿医疗
驯鹿医疗是一家处于临床阶段,致力于癌症创新疗法的生物技术公司,成立于2017年3月,由知名临床专家、科学家与资深投资人联合创立,致力于通过不断的临床研究,开发出真正解决临床问题的创新细胞类药物。目前公司拥有十余个涵盖血液肿瘤和实体瘤适应症的产品管线。通过与国外优秀抗体平台的合作及自主拥有的全人源抗体库的筛选,公司所有细胞类药物均采用下一代全人源抗体。目前已有三个CAR-T细胞产品进入临床阶段。
关于信达生物
“始于信,达于行”,开发出老百姓用得起的高质量生物药,是信达生物的理想和目标。信达生物成立于2011年,致力于开发、生产和销售用于治疗肿瘤等重大疾病的创新药物。2018年10月31日,信达生物制药在香港联合交易所有限公司主板上市,股票代码:01801。
目前,公司已建成贯通生物创新药开发全周期的高质量技术平台,包括研发、药学开发及产业化、临床研究和营销等平台,已建立起了一条包括20个在研新药品种的产品链,覆盖肿瘤、眼底病、自身免疫疾病、代谢疾病等四大疾病领域,14个品种进入临床试验,其中4个品种在临床III期研究,2个单抗产品的上市申请被国家药监局受理并被纳入优先审评,1个产品(信迪利单抗注射液,商品名:达伯舒®)获得国家药品监督管理局批准上市,获批的第一个适应症是复发/难治性经典型霍奇金淋巴瘤。
信达生物已组建了一支具有国际先进水平的高端生物药开发、产业化人才团队,包括众多海归专家,并与美国礼来制药、Adimab、Incyte和韩国Hanmi等国际制药公司达成战略合作。信达生物希望和大家一起努力,提高中国生物制药产业的发展水平,以满足百姓用药可及性和人民对生命健康美好愿望的追求。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。