Nature新发现:100% 癌细胞清除率!YTHDF1敲除助力肿瘤免疫疗法
来源:abcam 2019-06-14 17:06
YTHDF家族蛋白可以与mRNA上的m6A结合,从而调控mRNA的翻译。在YTHDF1敲除的小鼠上使用抗PD-L1抗体可完全清除癌细胞,这可能是因为负责抗原呈递的树突细胞中溶酶体蛋白的表达减少,抗原没有被分解而是激活了免疫反应。YTHDF家族蛋白除了在癌症研究中越来越为人关注,还在神经科学、发育学等领域引起了越来越多的重视。2019年3月25日发表在Nature上的一篇文章,将非常火热的抗癌免疫疗
YTHDF家族蛋白可以与mRNA上的m6A结合,从而调控mRNA的翻译。在YTHDF1敲除的小鼠上使用抗PD-L1抗体可完全清除癌细胞,这可能是因为负责抗原呈递的树突细胞中溶酶体蛋白的表达减少,抗原没有被分解而是激活了免疫反应。YTHDF家族蛋白除了在癌症研究中越来越为人关注,还在神经科学、发育学等领域引起了越来越多的重视。
2019年3月25日发表在Nature上的一篇文章,将非常火热的抗癌免疫疗法再次向前推进了一步。在试验中,癌细胞的清除率被从30%左右一下子提高到了100%。
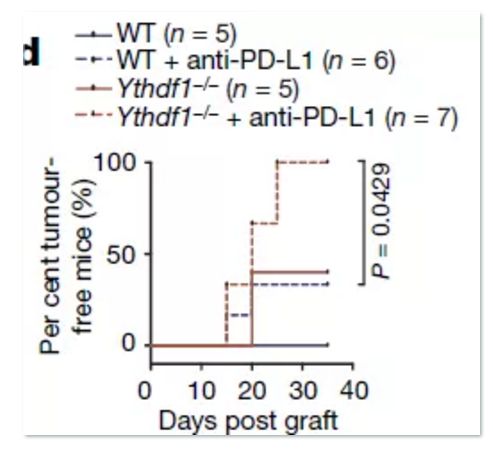
在YTHDF1敲除的小鼠上使用PD-L1抗体
20多天后移植的肿瘤就被杀光光
(图片来源此处)
这个YTHDF是何方神圣?
为何如此的厉害?
故事要从稍早的抗PD-1/PD-L1药物说起。
叫醒沉睡的T细胞
为了抗击癌症,人们尝试了各种各样的治疗方式。其中PD-1/PD-L1抗体治疗正逐渐发展。这一疗法曾彻底清除了美国前总统卡特脑内的转移瘤,并正在为广大癌症患者赶走病魔。

美国前总统吉米·卡特
(图片来源此处)
PD-1全名叫作程序性死亡受体1,PD-L1是程序性死亡受体-配体1。当癌症发生时,T细胞可以识别癌细胞上特异性的抗原来找到癌细胞,行使功能将其杀灭。但癌细胞可要狡猾得很,部分癌细胞会在细胞表面表达PD-L1与T细胞上的PD-1蛋白结合,从而“劝服”T细胞不要杀生,让自己苟活下来。
你永远叫不醒一个装睡的人,但你可以叫醒沉睡的T细胞。利用抗体药物阻断PD-1或PD-L1蛋白即可让T细胞重新上线,完成抗癌使命。
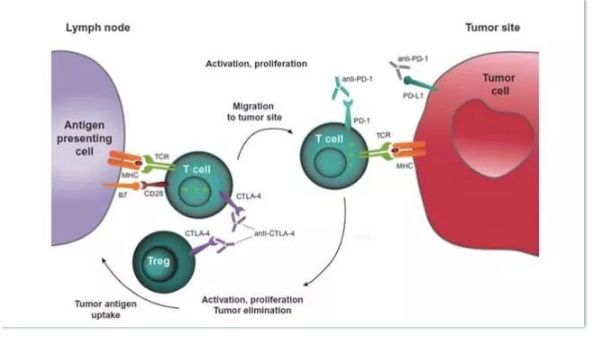
但是,抗PD-1/PD-L1的治疗方法并不是万能的,其抗非小细胞肺癌有效率约为30%,抗黑色素瘤有效率为40%上下,抗膀胱癌有效率50%,抗胃癌、食管癌和肝癌的有效率也在30%左右。 FDA的批文中给抗PD-1药物限定的适用范围是“高度微卫星不稳定性(MSI-H)或错配修复基因缺陷(dMMR)”的癌症。癌细胞的突变千千万万,有些癌细胞的伪装不是PD-L1或不止是PD-L1,这种情况下使用抗体药物效果就并不好。而即使是使用PD-1/PD-L1抗体有效的患者,也可能在大约一年后对药物产生耐药性。
斩草不除根,春风吹又生,更何况这是致命的癌症啊,抗PD-1/PD-L1的药物为何不总能完全杀死癌细胞呢?该疗法的高反应性与CD8+T细胞比例提高、新抗原负荷加大、肿瘤突变负荷增大相关;低反应性与成纤维细胞的 TGF-β信号通路有关 。
CD8+T细胞在细胞免疫中起到了重要作用
(图片来源此处)
另外,还有研究发现,T细胞并不是如同之前想象的那样直接冲上去就开始杀伤癌细胞,而是会在发现癌细胞后用干扰素-γ(IFN-γ)来向树突细胞(dendritic cell, DC)汇报,DC再用白介素-12(IL-12)来下令击杀。除此之外,树突细胞还负责加工抗原,将加工过的抗原呈递给杀伤性T细胞。
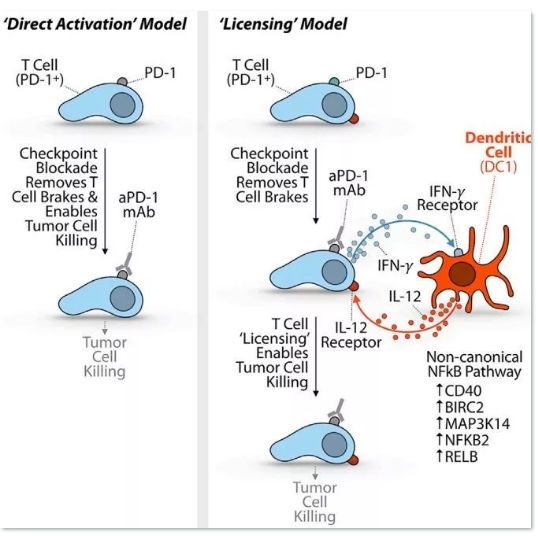
CD8+T细胞还需要树突细胞的辅助才能起效
(图片来源此处)
而在很多患者体内,新抗原的识别并没有引起T细胞的持久激活,使得免疫治疗不能毕其功于一役。
新的思路,新的希望
mRNA 的m6 A修饰(N6-腺苷酸甲基化)可以调控基因的表达,而YTHDF1蛋白会与m6 A结合并调控mRNA的翻译效率。已经有不少文献报道,干扰m6 A通路会调控致癌基因表达的过程有可能可以起到抗癌的作用。这种作用不仅可以发生在肿瘤细胞表达的异常上,也可能体现在患者自身的免疫系统差别上。
于是,就有研究者想到研究m6 A以及YTHDF1在宿主抗肿瘤免疫反应中的作用。
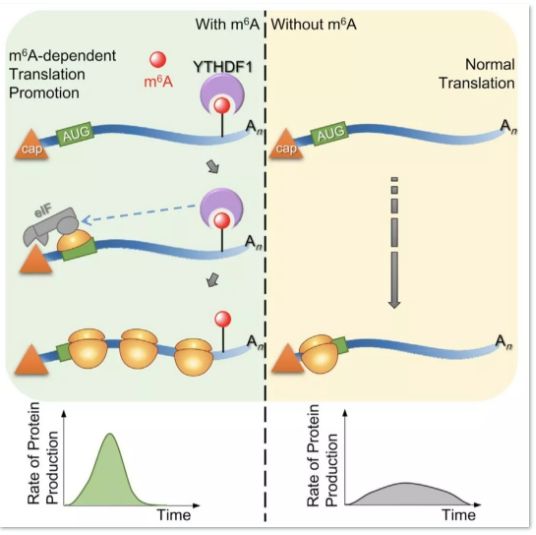
YTHDF1可以于m6A结合来提高mRNA翻译效率
(图片来源此处)
而实验的结果也验证了研究者的猜想。YTHDF1敲除的小鼠,荷瘤后肿瘤更难生长,且CD8+T细胞比例更高、NK细胞作用更强。
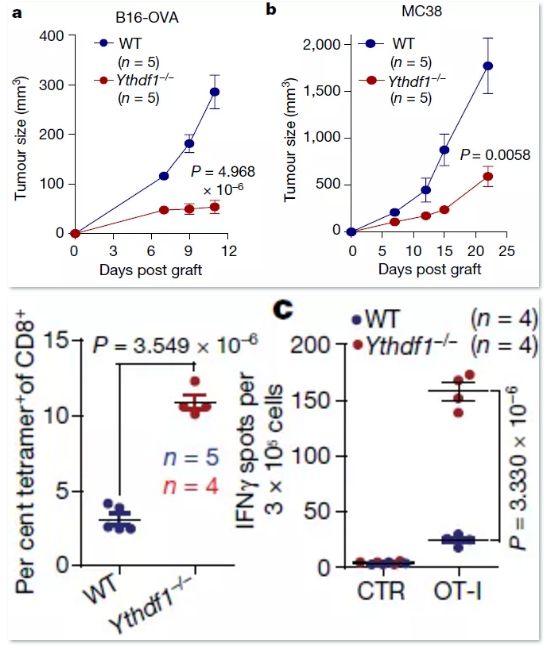
两种肿瘤在YTHDF1敲除的小鼠中生长都更缓慢,小鼠的CD8+细胞数目和IFN γ数目在敲除小鼠中都更高
(图片来源此处)
YTHDF1是怎么影响肿瘤生长的呢?对YTHDF1敲除细胞的转录组分析发现,蛋白质表达变化最大的是溶酶体蛋白。
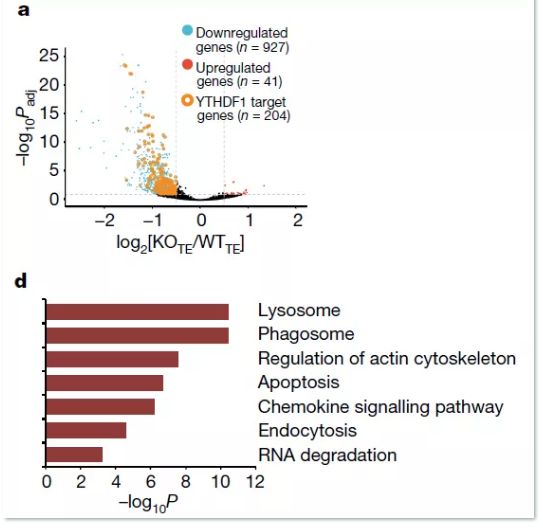
YTHDF1敲除后,溶酶体蛋白下降最多
(图片来源此处)
而使用蛋白酶抑制剂E64处理野生型细胞也可以显著降低肿瘤体积。研究者推测,YTHDF1敲除降低了溶酶体蛋白的表达,减少了树突细胞对抗原的消化,从而使树突细胞能更长久地刺激CD8+T细胞杀灭癌细胞。
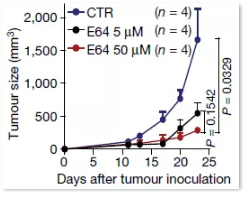
蛋白酶抑制剂E64一样可以减缓肿瘤生长
(图片来源此处)
而如果在敲除YTHDF1后同时使用抗PD-L1药物,就将肿瘤清除率从单纯用药时30%左右提高到了100%。

在YTHDF1敲除的小鼠上使用PD-L1抗体,
肿瘤清除率达到100%
(图片来源此处)
这一发现也为原本不适用PD-1/PD-L1抗体疗法的患者带来了希望。或许抑制了YTHDF1蛋白就可以大大提高免疫疗法的适用性。
更多 更多
除了YTHDF1,YTHDF蛋白家族的其他两名成员——YTHDF2和YTHDF3也被发现有重要的调控基因表达的功能。YTHDF2被发现可以介导mRNA降解从而导致斑马鱼幼鱼发育缓慢;YTHDF3也被报道可以促进基因的表达;甚至YTHDF1也被证明与记忆生成相关。
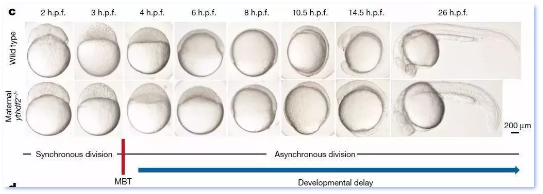
YTHDF2蛋白敲除使得斑马鱼幼鱼发育减缓
(图片来源此处)
YTHDF蛋白家族是研究领域一颗冉冉升起的新星,它为我们打开了一扇大门。通过调控这些蛋白,我们或许可以操纵很多蛋白质的表达,从而治疗疾病或者更为精细地研究细胞的功能。小艾也怀揣好奇,满心期待,希望与您一起探索这篇未知的领域,为人类带来更健康、更美好的生活。
m6A 相关研究工具列表:
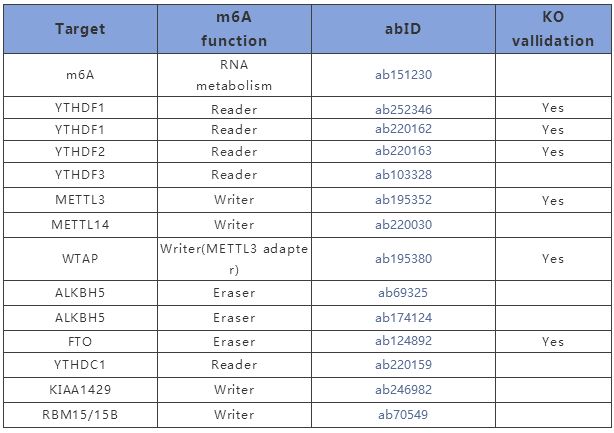
14篇文献揭示m6A的功能与分布,欢迎点击“阅读原文”查看
参考文献:
Epitranscriptomic m 6 A Regulation of Axon Regeneration in the Adult Mammalian Nervous System[J]. Neuron, 2018, 97(2):313.
Han D, Liu J, Chen C, et al. Anti-tumour immunity controlled through mRNA m 6 A methylation and YTHDF1 in dendritic cells[J]. Nature, 2019, 566(7743): 270.
Dominissini D, Moshitch-Moshkovitz S, Schwartz S, et al. Topology of the human and mouse m6A RNA methylomes revealed by m6A-seq[J]. NATURE, 2012, 485(7397):201-206.
Wang X, Lu Z, Gomez A, et al. N6-methyladenosine-dependent regulation of messenger RNA stability[J]. Nature, 2013, 505(7481):117-120.
Garris C, Arlauckas S, Kohler R, et al. Successful Anti-PD-1 Cancer Immunotherapy Requires T Cell-Dendritic Cell Crosstalk Involving the Cytokines IFN-g and IL-12. Immunity, 2018, 49(6):1148-1161.
Zhao B S, Wang X, Beadell A V, et al. m6A-dependent maternal mRNA clearance facilitates zebrafish maternal-to-zygotic transition[J]. Nature, 2017, 542(7642):475-478.
Wang X, Zhao B S, Roundtree I A, et al. N6-methyladenosine Modulates Messenger RNA Translation Efficiency[J]. Cell, 2015, 161(6):1388-1399.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


