Cell:揭示细胞读取和复制DNA机制
来源:本站原创 2019-05-28 23:17
2019年5月28日讯/生物谷BIOON/---来自美国约翰霍普金斯大学医学院的Cynthia Wolberger博士、James Berger博士及其同事们揭开了DNA如何组装和保存遗传信息的各个方面。他们仔细研究了DNA复制机器的各个部分如何组装在一起。新研究揭示DNA组装的意外变化为了让DNA中的基因“开启”和“关闭”,细胞中的酶必须与核小体相互作用,其中作为一种复合物,核小体含有允许细胞组
2019年5月28日讯/生物谷BIOON/---来自美国约翰霍普金斯大学医学院的Cynthia Wolberger博士、James Berger博士及其同事们揭开了DNA如何组装和保存遗传信息的各个方面。他们仔细研究了DNA复制机器的各个部分如何组装在一起。
新研究揭示DNA组装的意外变化
为了让DNA中的基因“开启”和“关闭”,细胞中的酶必须与核小体相互作用,其中作为一种复合物,核小体含有允许细胞组装DNA的蛋白。一种称为Dot1L的酶在混合谱系白血病(mixed lineage leukemia)---一种儿童白血病---中发生突变。
一种称为泛素的小蛋白标签被附着到核小体上以协助招募Dot1L。然而,酶Dot1L如何在物理上与核小体或这种泛素标签连接在一起在此之前一直是不清楚的。为此,约翰霍普金斯大学医学院生物物理学与生物物理化学教授Cynthia Wolberger博士和Wolberger实验室博士后研究员Evan Worden博士在一项新的研究中,使用一种称为低温电镜(cryo-EM)的成像工具来冻存核小体中的分子和Dot1L,以便观察这两者之间如何相互作用。
他们在这项新的研究中取得的发现是出乎意料的:Dot1L改变了核小体的形状,使得它与Dot1L酶更紧密地结合在一起。相关研究结果近期发表在Cell期刊上,论文标题为“Mechanism of Cross-talk between H2B Ubiquitination and H3 Methylation by Dot1L”。
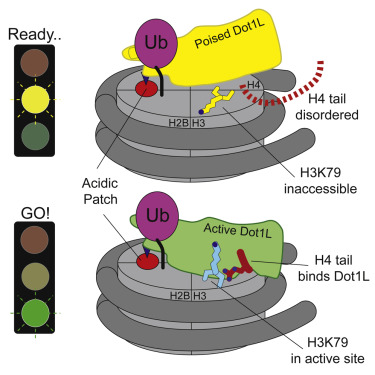
用cryo-EM拍摄的高分辨率图像揭示了核小体核心中前所未有的变化。当Dot1L连接在一起时,来自核小体中心的尾部向上摆动,将这种酶固定到它的表面上,从而导致核小体结构发生一系列其他的变化。
这些研究人员说,这种观察代表了他们对遗传病的思考方式的转变,这是因为核小体结构的变化会影响人体的细胞如何获取它们的DNA。特别是对于儿童白血病,发现核小体如何改变形状,使得它与Dot1L很好地匹配在一起,从而可能会为寻找靶向这种连接的新疗法提供机会。
科学家们拼凑出DNA复制机器的工作原理
它在整个人体中发生了数万亿次:微小的分子机器将细胞中的DNA进行复制,然后产生60亿个DNA片段的两个完全相同的拷贝,同时不会产生错误。约翰霍普金斯大学医学院生物物理学与生物物理化学教授James Berger说道,“这种精确度是非常显著的,而且它是在如此小的规模上发生的。”
科学家们使用术语“复制体(replisome)”来指代复制DNA的分子机器。复制体是蛋白和酶的集合,它们连接在一起形成DNA复制机器。Berger说,“我们理解复制体的不同部分如何发挥作用,但是我们并不理解它们如何协同发挥作用。” Berger的实验室专门研究DNA如何自我复制。
Berger说,复制体就像一台自给自足的复印机,卷入一片DNA并吐出两份。让这台复印机运作的马达称为解旋酶。它解除配对并解开双链DNA,因此这种分子复制机器能够访问和复制存储在遗传密码中的分子信息。像许多汽车马达一样,解旋酶由六个圆柱体或着说“环”驱动,它环绕DNA并沿着DNA移动。
Berger的研究团队研究了细菌,发现一种名为DnaC的酶如何将解旋酶的一个环加载到DNA上。在2019年2月发表在Molecular Cell期刊上的一篇论文中,这些研究人员发现DnaC与解旋酶结合,并且使用它的六个臂中的一个,将解旋酶的这个环打开,从而将这个环连接到DNA链上。DnaC随后将这个环关闭。
Berger实验室正在继续研究DnaC如何从这种分子复制机器中弹出,解旋酶马达如何固定在分子复制机器上以及解旋酶如何沿着DNA移动。这些发现将有助于为靶向解旋酶进行抗菌治疗铺平道路,并将提供关于发生突变的解旋酶发生故障时遗传疾病如何产生的新见解。(生物谷 Bioon.com)
参考资料:
Evan J. Worden et al. Mechanism of Cross-talk between H2B Ubiquitination and H3 Methylation by Dot1L, Cell (2019). DOI: 10.1016/j.cell.2019.02.002.
Ernesto Arias-Palomo et al. Physical Basis for the Loading of a Bacterial Replicative Helicase onto DNA, Molecular Cell (2019). DOI: 10.1016/j.molcel.2019.01.023.
新研究揭示DNA组装的意外变化
为了让DNA中的基因“开启”和“关闭”,细胞中的酶必须与核小体相互作用,其中作为一种复合物,核小体含有允许细胞组装DNA的蛋白。一种称为Dot1L的酶在混合谱系白血病(mixed lineage leukemia)---一种儿童白血病---中发生突变。
一种称为泛素的小蛋白标签被附着到核小体上以协助招募Dot1L。然而,酶Dot1L如何在物理上与核小体或这种泛素标签连接在一起在此之前一直是不清楚的。为此,约翰霍普金斯大学医学院生物物理学与生物物理化学教授Cynthia Wolberger博士和Wolberger实验室博士后研究员Evan Worden博士在一项新的研究中,使用一种称为低温电镜(cryo-EM)的成像工具来冻存核小体中的分子和Dot1L,以便观察这两者之间如何相互作用。
他们在这项新的研究中取得的发现是出乎意料的:Dot1L改变了核小体的形状,使得它与Dot1L酶更紧密地结合在一起。相关研究结果近期发表在Cell期刊上,论文标题为“Mechanism of Cross-talk between H2B Ubiquitination and H3 Methylation by Dot1L”。

图片来自Cell, 2019, doi:10.1016/j.cell.2019.02.002。
用cryo-EM拍摄的高分辨率图像揭示了核小体核心中前所未有的变化。当Dot1L连接在一起时,来自核小体中心的尾部向上摆动,将这种酶固定到它的表面上,从而导致核小体结构发生一系列其他的变化。
这些研究人员说,这种观察代表了他们对遗传病的思考方式的转变,这是因为核小体结构的变化会影响人体的细胞如何获取它们的DNA。特别是对于儿童白血病,发现核小体如何改变形状,使得它与Dot1L很好地匹配在一起,从而可能会为寻找靶向这种连接的新疗法提供机会。
科学家们拼凑出DNA复制机器的工作原理
它在整个人体中发生了数万亿次:微小的分子机器将细胞中的DNA进行复制,然后产生60亿个DNA片段的两个完全相同的拷贝,同时不会产生错误。约翰霍普金斯大学医学院生物物理学与生物物理化学教授James Berger说道,“这种精确度是非常显著的,而且它是在如此小的规模上发生的。”
科学家们使用术语“复制体(replisome)”来指代复制DNA的分子机器。复制体是蛋白和酶的集合,它们连接在一起形成DNA复制机器。Berger说,“我们理解复制体的不同部分如何发挥作用,但是我们并不理解它们如何协同发挥作用。” Berger的实验室专门研究DNA如何自我复制。
Berger说,复制体就像一台自给自足的复印机,卷入一片DNA并吐出两份。让这台复印机运作的马达称为解旋酶。它解除配对并解开双链DNA,因此这种分子复制机器能够访问和复制存储在遗传密码中的分子信息。像许多汽车马达一样,解旋酶由六个圆柱体或着说“环”驱动,它环绕DNA并沿着DNA移动。
Berger的研究团队研究了细菌,发现一种名为DnaC的酶如何将解旋酶的一个环加载到DNA上。在2019年2月发表在Molecular Cell期刊上的一篇论文中,这些研究人员发现DnaC与解旋酶结合,并且使用它的六个臂中的一个,将解旋酶的这个环打开,从而将这个环连接到DNA链上。DnaC随后将这个环关闭。
Berger实验室正在继续研究DnaC如何从这种分子复制机器中弹出,解旋酶马达如何固定在分子复制机器上以及解旋酶如何沿着DNA移动。这些发现将有助于为靶向解旋酶进行抗菌治疗铺平道路,并将提供关于发生突变的解旋酶发生故障时遗传疾病如何产生的新见解。(生物谷 Bioon.com)
参考资料:
Evan J. Worden et al. Mechanism of Cross-talk between H2B Ubiquitination and H3 Methylation by Dot1L, Cell (2019). DOI: 10.1016/j.cell.2019.02.002.
Ernesto Arias-Palomo et al. Physical Basis for the Loading of a Bacterial Replicative Helicase onto DNA, Molecular Cell (2019). DOI: 10.1016/j.molcel.2019.01.023.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


