Cell:活性更强的长寿基因SIRT6意味着更长的寿命?
来源:本站原创 2019-05-04 15:12
2019年5月4日讯/生物谷BIOON/---几个世纪以来,探险家们一直梦想着能有不老泉,它的泉水具有治疗作用,能使老年人恢复活力,并无限期地延长寿命。然而,在一项新的研究中,来自美国罗切斯特大学的研究人员发现了更多的证据表明长寿的关键在于一个称为SIRT6的基因。他们发现基因SIRT6在具有更长寿命的物种中负责更高效的DNA修复。这一发现揭示了开发抗衰老干预措施的新靶标,可能有助于阻止年龄相关性
2019年5月4日讯/生物谷BIOON/---几个世纪以来,探险家们一直梦想着能有不老泉,它的泉水具有治疗作用,能使老年人恢复活力,并无限期地延长寿命。
然而,在一项新的研究中,来自美国罗切斯特大学的研究人员发现了更多的证据表明长寿的关键在于一个称为SIRT6的基因。他们发现基因SIRT6在具有更长寿命的物种中负责更高效的DNA修复。这一发现揭示了开发抗衰老干预措施的新靶标,可能有助于阻止年龄相关性疾病。相关研究结果近期发表在Cell期刊上,论文标题为“SIRT6 Is Responsible for More Efficient DNA Double-Strand Break Repair in Long-Lived Species”。论文通讯作者为罗切斯特大学生物学教授Vera Gorbunova和Andrei Seluanov。
不可避免的双链断裂
随着人类和其他哺乳动物年龄的增长,它们的DNA越来越容易断裂,这可能导致基因重排和突变---癌症和衰老的标志。出于这个原因,人们长期以来假设DNA修复在决定有机体的寿命方面起着重要作用。虽然吸烟等行为会加剧DNA中的双链断裂(DSB),但是这种断裂本身是不可避免的。论文共同作者、罗切斯特大学生物医学遗传学教授Dirk Bohmann 说道,“它们总是在体内存在着,即使你是超级健康的。DSB存在的主要原因之一是氧化损伤,这是因为我们需要氧气来呼吸,这种断裂是不可避免的。”
Bohmann说,相比于寿命较长的有机体,像老鼠这样的有机体在相对较短的生命中积累DNA双链断裂的机会较小。“但是,如果你想活50年左右,那么就需要构建一个系统来修复这些断裂。”
长寿基因
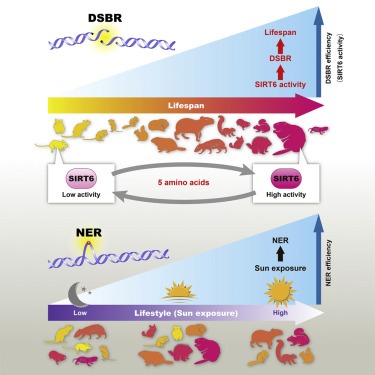
SIRT6通常被称为“长寿基因(longevity gene)”,这是因为它在排列蛋白和招募修复DNA断裂的酶方面发挥着重要作用;另外,缺乏这个基因的小鼠过早衰老,而携带这个基因额外拷贝的小鼠则活得更长。这些研究人员猜测如果更有效的DNA修复是更长寿命所必需的,那么寿命更长的有机体可能进化出更有效的DNA修复调节因子。 SIRT6活性因此在长寿物种中增强了吗?
为了验证这个观点,这些研究人员分析了18种寿命从3年(小鼠)到32年(裸鼹鼠和海狸)的啮齿类动物物种的DNA修复。他们发现具有较长寿命的啮齿类动物也经历了更有效的DNA修复,这是因为它们的SIRT6基因的表达产物---SIRT6蛋白---更为强效。这也就是说,SIRT6在每个物种中都不相同。相反,这个基因与长寿共同进化,变得更有效,因此具有更强SIRT6活性的物种活得更长。Bohmann说,“SIRT6蛋白似乎是寿命的主要决定因素。我们证实如果在细胞水平上,这种DNA修复效果更好,那么在有机体水平上,就具有更长的寿命。”
这些研究人员随后分析了小鼠中发现的较弱的SIRT6蛋白与海狸中发现的较强的SIRT6之间的分子差异。Gorbunova说,他们鉴定出5个氨基酸负责让更强的SIRT6蛋白“在修复DNA方面更具活性,在酶功能方面表现更好”。当他们分别将海狸和小鼠SIRT6插入到人体细胞中时,海狸SIRT6要比小鼠SIRT6更好地减少应激诱导的DNA损伤。相比于携带着小鼠SIRT6的果蝇,海狸SIRT6也更好地延长了携带海狸SIRT6的果蝇的寿命。
具有更为强效的SIRT6的物种?
Seluanov说,虽然看起来人类SIRT6在功能上已得到优化,但“还有比人类更长寿的其他物种”。这项研究的后续步骤涉及分析那些比人类更长寿的物种---比如可以存活200多年的北极露脊鲸(bowhead whale)---是否已经进化出更为强效的SIRT6基因。
Gorbunova说,最终目标是阻止人类中的年龄相关性疾病。“如果由于DNA因年龄的增加变得杂乱而患上疾病,那么我们就能利用这样的研究来制定可以延缓癌症和其他退行性疾病的干预措施。”(生物谷 Bioon.com)
参考资料:
Xiao Tian et al. SIRT6 Is Responsible for More Efficient DNA Double-Strand Break Repair in Long-Lived Species. Cell, 2019, doi:10.1016/j.cell.2019.03.043.
然而,在一项新的研究中,来自美国罗切斯特大学的研究人员发现了更多的证据表明长寿的关键在于一个称为SIRT6的基因。他们发现基因SIRT6在具有更长寿命的物种中负责更高效的DNA修复。这一发现揭示了开发抗衰老干预措施的新靶标,可能有助于阻止年龄相关性疾病。相关研究结果近期发表在Cell期刊上,论文标题为“SIRT6 Is Responsible for More Efficient DNA Double-Strand Break Repair in Long-Lived Species”。论文通讯作者为罗切斯特大学生物学教授Vera Gorbunova和Andrei Seluanov。

图片来自Cell, 2019, doi:10.1016/j.cell.2019.03.043。
不可避免的双链断裂
随着人类和其他哺乳动物年龄的增长,它们的DNA越来越容易断裂,这可能导致基因重排和突变---癌症和衰老的标志。出于这个原因,人们长期以来假设DNA修复在决定有机体的寿命方面起着重要作用。虽然吸烟等行为会加剧DNA中的双链断裂(DSB),但是这种断裂本身是不可避免的。论文共同作者、罗切斯特大学生物医学遗传学教授Dirk Bohmann 说道,“它们总是在体内存在着,即使你是超级健康的。DSB存在的主要原因之一是氧化损伤,这是因为我们需要氧气来呼吸,这种断裂是不可避免的。”
Bohmann说,相比于寿命较长的有机体,像老鼠这样的有机体在相对较短的生命中积累DNA双链断裂的机会较小。“但是,如果你想活50年左右,那么就需要构建一个系统来修复这些断裂。”
长寿基因
SIRT6通常被称为“长寿基因(longevity gene)”,这是因为它在排列蛋白和招募修复DNA断裂的酶方面发挥着重要作用;另外,缺乏这个基因的小鼠过早衰老,而携带这个基因额外拷贝的小鼠则活得更长。这些研究人员猜测如果更有效的DNA修复是更长寿命所必需的,那么寿命更长的有机体可能进化出更有效的DNA修复调节因子。 SIRT6活性因此在长寿物种中增强了吗?
为了验证这个观点,这些研究人员分析了18种寿命从3年(小鼠)到32年(裸鼹鼠和海狸)的啮齿类动物物种的DNA修复。他们发现具有较长寿命的啮齿类动物也经历了更有效的DNA修复,这是因为它们的SIRT6基因的表达产物---SIRT6蛋白---更为强效。这也就是说,SIRT6在每个物种中都不相同。相反,这个基因与长寿共同进化,变得更有效,因此具有更强SIRT6活性的物种活得更长。Bohmann说,“SIRT6蛋白似乎是寿命的主要决定因素。我们证实如果在细胞水平上,这种DNA修复效果更好,那么在有机体水平上,就具有更长的寿命。”
这些研究人员随后分析了小鼠中发现的较弱的SIRT6蛋白与海狸中发现的较强的SIRT6之间的分子差异。Gorbunova说,他们鉴定出5个氨基酸负责让更强的SIRT6蛋白“在修复DNA方面更具活性,在酶功能方面表现更好”。当他们分别将海狸和小鼠SIRT6插入到人体细胞中时,海狸SIRT6要比小鼠SIRT6更好地减少应激诱导的DNA损伤。相比于携带着小鼠SIRT6的果蝇,海狸SIRT6也更好地延长了携带海狸SIRT6的果蝇的寿命。
具有更为强效的SIRT6的物种?
Seluanov说,虽然看起来人类SIRT6在功能上已得到优化,但“还有比人类更长寿的其他物种”。这项研究的后续步骤涉及分析那些比人类更长寿的物种---比如可以存活200多年的北极露脊鲸(bowhead whale)---是否已经进化出更为强效的SIRT6基因。
Gorbunova说,最终目标是阻止人类中的年龄相关性疾病。“如果由于DNA因年龄的增加变得杂乱而患上疾病,那么我们就能利用这样的研究来制定可以延缓癌症和其他退行性疾病的干预措施。”(生物谷 Bioon.com)
参考资料:
Xiao Tian et al. SIRT6 Is Responsible for More Efficient DNA Double-Strand Break Repair in Long-Lived Species. Cell, 2019, doi:10.1016/j.cell.2019.03.043.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


