Nature子刊:马莉团队揭示这一lncRNA可预防骨质疏松和肿瘤骨转移
来源:生物世界 2024-03-18 10:27
破骨细胞是一类起源于单核/巨噬细胞系的多核巨细胞(MGC),负责骨基质和矿物的吸收。
德克萨斯大学MD安德森癌症中心马莉教授团队在 Nature Communications 期刊发布了题为:Long noncoding RNA Malat1 protects against osteoporosis and bone metastasis 的研究论文。
该研究发现并揭示lncRNA-MALAT1预防骨质疏松症和肿瘤骨转移的分子机制。


马莉教授
破骨细胞是一类起源于单核/巨噬细胞系的多核巨细胞(MGC),负责骨基质和矿物的吸收。破骨细胞的生成由巨噬细胞集落刺激因子(M-CSF)和核因子κB受体活化因子配体(RANKL)启动,这些因子诱导破骨细胞标志物的表达,随后破骨细胞前体的成熟和细胞-细胞融合。作为破骨细胞生成的主调控因子,活化T细胞核因子1(NFATC1)由RANKL诱导,然后与其他转录因子形成复合物,激活自身编码基因以及其他参与破骨细胞粘附、细胞融合和骨吸收的基因的转录。
长链非编码RNA(lncRNA)是长度超过200个核苷酸且不翻译蛋白质的转录本。lncRNA通常具有低进化保守性,而MALAT1是少数几个例外之一,这是一种高度保守的细胞核内lncRNA,在许多组织中大量表达。
2018年,马莉团队在 Nature Genetics 期刊发表论文,通过靶向失活和基因挽救实验发现,MALAT1是乳腺癌肺转移的抑制因子。

而另一方面,MALAT1敲除小鼠是可存活和正常发育的。
为了探索MALAT1在生理和病理过程中的基本作用,马莉团队发现,MALAT1在人类和小鼠的破骨细胞生成过程中被下调。值得注意的是,小鼠MALAT1缺陷促进了骨质疏松症和黑色素瘤和乳腺肿瘤细胞的骨转移,而这可以通过MALAT1基因的回补实验来拯救。
从机制上来说,MALAT1结合到Tead3蛋白(这是一种巨噬细胞-破骨细胞特异性的Tead家族成员),阻止Tead3结合并激活破骨细胞生成的主要调节因子NFATC1,从而抑制NFATC1介导的基因转录和破骨细胞分化。
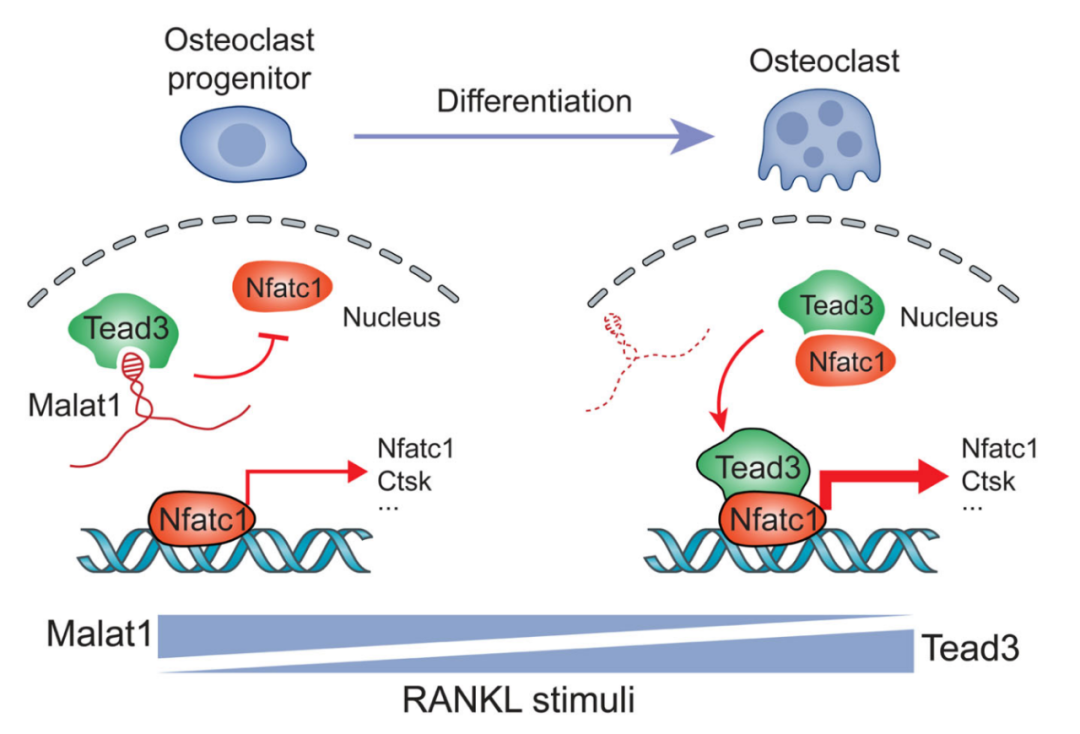
Malat1-Tead3-Nfatc1轴调控破骨细胞生成的模式图
值得注意的是,对临床骨样本的单细胞转录组分析显示,前体破骨细胞和破骨细胞中MALAT1表达的减少与骨质疏松症和转移性骨病变相关。
总的来说,这项研究确定MALAT1是一种保护骨质疏松症和肿瘤骨转移的lncRNA。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


