Cell Rep Med:髓样细胞通过GP130信号协调诱导胶质瘤细胞内和细胞外的化学耐药途径
来源:生物谷原创 2024-08-31 12:54
本研究发现GAMs在单个肿瘤细胞水平和治疗药物的全身递送水平上都促进了化疗耐药。临床和临床前研究表明,GAMs是GBMs辅助治疗的合法靶点。
胶质母细胞瘤(GBMs)是成人最常见的恶性脑肿瘤,目前对GBMs的临床治疗主要是姑息性的,GBMs对化疗的不良反应是成功治疗的主要障碍。促进替莫唑胺(TMZ)耐药的一个关键因素是肿瘤细胞中的DNA损伤反应(DDR)途径。
tmz诱导的DNA单链断裂的修复是由共济失调毛细血管扩张和rad3相关(ATR)激酶控制的,该激酶与9-1-1 DNA夹复合体一起被招募到停滞或崩溃的复制叉上。这些分子合作为DNA修复提供了一个时间窗口,并促进DNA复制受阻后的恢复。
GBMs的耐药不仅受细胞内在途径的调控,还受肿瘤微环境的诱发。髓样细胞;包括骨髓源性巨噬细胞和小胶质细胞)和血管细胞是GBMs中最丰富的微环境细胞群,并发挥肿瘤支持作用。GBMs中广泛的血管网络使肿瘤肿块迅速扩张。
由于肿瘤内血管保持着残留的、局部区域异质性的屏障功能,因此,在GBMs中,gmb血管不能充分地向GBMs提供血源性治疗药物。这种血肿瘤屏障(BTB)在一定程度上概括了血脑屏障的机制特征,这是大脑稳态所必需的。然而,尽管在治疗BTB方面做出了巨大的努力,但从药理学上改善治疗药物在血管壁上的转运的有效转化方法仍然很少。
已知GAMs通过在GBMs亚群中诱导不同的病理特征而具有致瘤功能。例如,GAMs在促进化疗耐药或加速GBM血管化方面的作用依赖于GBM。然而,目前尚不清楚GAMs是否在单个肿瘤的肿瘤进展中具有多种协同作用。

图片来源:https://doi.org/10.1016/j.xcrm.2024.101658
近日,来自德国慕尼黑大学附属医院的研究者们在Cell Rep Med杂志上发表了题为“Myeloid cells coordinately induce glioma cell-intrinsic and cell-extrinsic pathways for chemoresistance via GP130 signaling”的文章,该研究描述了替莫唑胺耐药的总体机制,并概述了一种可翻译的策略与预测标记物,以改善胶质母细胞瘤的化疗。
DNA损伤反应(DDR)和血肿瘤屏障(BTB)限制了原发性脑肿瘤如胶质母细胞瘤(GBMs)的化疗成功,因此,GBMs几乎无一例外地复发并带来致命的后果。在这里,研究者发现胶质母细胞瘤和髓细胞的相互作用通过激活GP130受体信号同时在遗传和血管水平上诱导化疗耐药,这可以通过治疗来解决。
在这里,研究者表明GAMs在胶质母细胞瘤中发挥了总体的病理协调功能。研究者从人GBMs、表达人蛋白的GBM小鼠模型和人源化器官型培养中获得的转录组学和免疫组织学数据表明,GBMs和GAMs之间的旁分泌信号诱导肿瘤细胞对替莫唑胺产生抗性,同时促进血肿瘤屏障的形成。因此,GAMs为胶质母细胞瘤提供了双重保护:单个胶质母细胞瘤细胞获得了更高的DNA修复能力,并且替莫唑胺在肿瘤内的传递减弱。

Humanin在hGBMs中强烈表达
图片来源:https://doi.org/10.1016/j.xcrm.2024.101658
值得注意的是,这两种机制都依赖于单一信号提示,并且可以通过减弱GP130受体活性来同步抑制。GP130阻断可减弱DDR活性和BTB的形成,从而提高临床前化疗疗效。总的来说,本研究报告了GAMs的中心病理协调功能和可翻译的策略,以提高胶质母细胞瘤的护理标准。
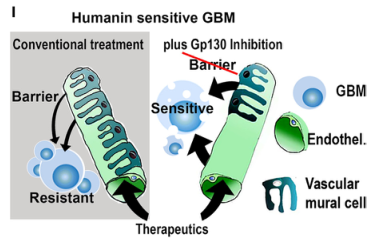
GP130阻断抑制了人蛋白介导的BTB形成,提高了化疗疗效和生存率
图片来源:https://doi.org/10.1016/j.xcrm.2024.101658
综上所述,本研究发现GAMs在单个肿瘤细胞水平和治疗药物的全身递送水平上都促进了化疗耐药。临床和临床前研究表明,GAMs是GBMs辅助治疗的合法靶点。然而,gam导向的治疗也很清楚,需要仔细表征肿瘤实质和GBM细胞,以便对个体进行特定治疗。
本研究符合这些严格的标准,并概述了临床前策略,以确定GP130抑制剂具有总体协同效应以支持TMZ疗效的人敏感GBMs,因此,这为提高大量GBMs患者的护理标准提供了基础。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


