研究揭示非酒精性脂肪肝病发生发展和阿尔兹海默病的关键调控分子
来源:中山大学 2024-04-05 10:57
该研究基于GEO数据库、临床样本分析、转基因小鼠模型验证等,证明了AD患者血清中Kallistatin含量显著增多;明确了KAL-TG小鼠出现记忆认知功能、海马突触可塑性下降及谷氨酸稳态失衡。
Kallistatin(KAL),由SERPINA4编码,是主要表达在肝细胞中的分泌蛋白。高国全教授团队长期从事糖尿病、肿瘤代谢与病理性血管新生关键调控分子的机制研究,以往的研究证明了糖尿病患者外周血中的KAL水平明显升高,可以激活核因子κB(NF-κB)信号通路,导致糖尿病伤口组织的炎症。目前团队在该研究领域取得了新的进展:
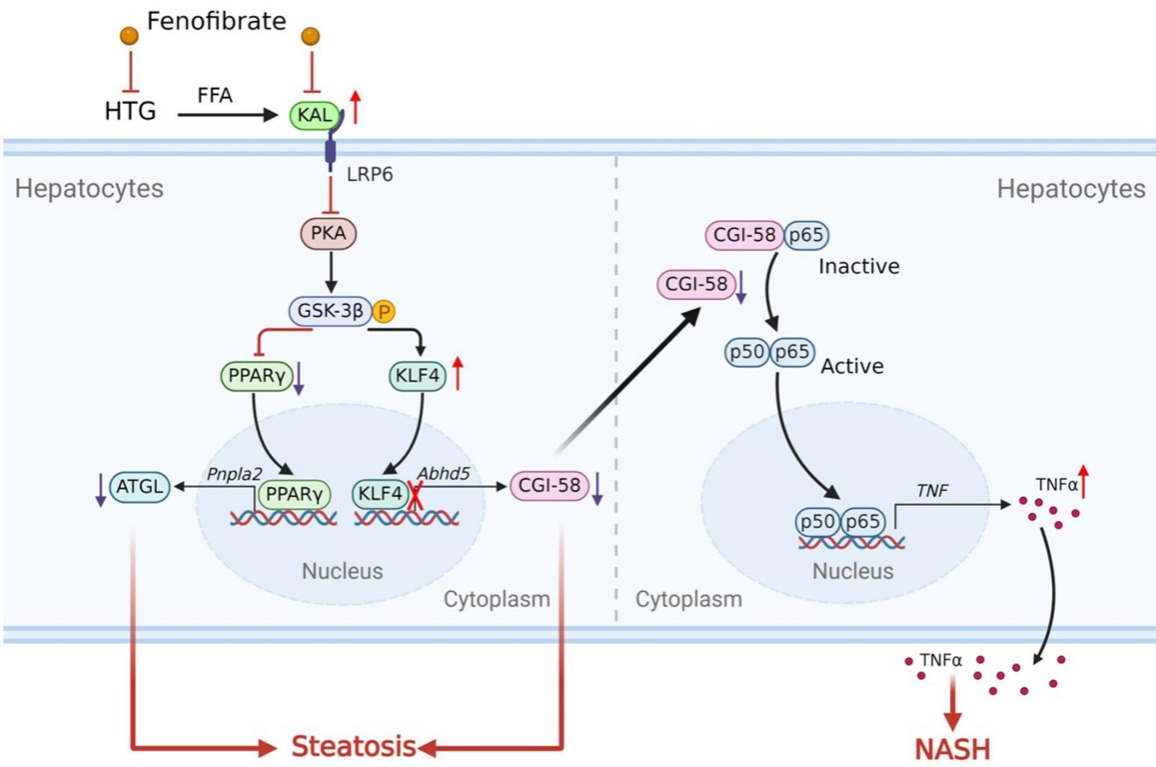
非酒精性脂肪肝病(Non-alcoholic fatty liver disease,NAFLD)是一系列肝脏相关疾病的总称,包括肝脂肪变性、非酒精性脂肪性肝炎(NASH)和肝硬化等肝脏疾病,全球NAFLD的患病率高达25%。在亚洲有很大比例的NAFLD病人并不肥胖,文献报道,非肥胖型的NAFLD病人甘油三酯水平通常更高;高脂血症,特别是高甘油三酯血症,是NAFLD的独立危险因素。但是介导高脂血症和NAFLD进程的关键调控分子尚不明确。
中山大学中山医学院高国全、周倜、杨霞教授团队在Signal Transduction and Targeted Therapy上发表了题为“Elevated Kallistatin promotes the occurrence and progression of non-alcoholic fatty liver disease”的研究论文。该研究基于数据库分析、临床样本分析、转基因小鼠模型和转录组学研究等,证明了HTG中异常升高的肝分泌因子KAL通过靶向CGI-58/NF-κB/TNF-α信号通路参与调控NAFLD的发生和发展。该研究明确了介导高脂血症向NAFLD发展的关键调控分子,阐明了KAL通过LRP6/PKA/GSK3β信号通路下调TG水解的关键酶ATGL及其共激活因子CGI-58导致肝脂肪变性,下调的CGI-58通过非ATGL依赖的途径激活NF-κB p65/TNFα炎症通路促进NASH的发生,同时揭示了HTG中KAL上调的机制。这些发现为阻断高脂血症向脂肪变性及NASH进展提供了新思路和新靶点,本研究聚焦中国常见的非肥胖型NAFLD人群,具有较强的临床价值。专职科研人员方珍珍副研究员为论文的第一作者。
阿尔茨海默病(Alzheimer's disease,AD)是一种进行性神经退行性疾病,也是一种高度异质性的衰老相关疾病,是认知功能下降最常见的原因。随着人口老龄化问题的逐渐加剧,AD已然成为一个全球公共卫生问题,因此对AD的发病原因和治疗靶点的研究一直是神经科学领域的热点和难点。越来越多的报道表明代谢紊乱和AD患者认知障碍之间存在密切关系。糖尿病、高脂血症及肥胖均为AD的高风险因素。
2024年3月14日,中山大学中山医学院齐炜炜、高国全、杨霞教授团队在Pharmacological Research上发表了题为“Kallistatin leads to cognition impairment via downregulating glutamine synthetase”的研究论文。该研究基于GEO数据库、临床样本分析、转基因小鼠模型验证等,证明了AD患者血清中Kallistatin含量显著增多;明确了KAL-TG小鼠出现记忆认知功能、海马突触可塑性下降及谷氨酸稳态失衡,证明过表达kallistatin通过破坏谷氨酸-谷氨酰胺循环诱发谷氨酸兴奋性毒性;分子水平上,发现Kallistatin通过调节谷氨酰胺合成酶(GS)的乙酰化-泛素化修饰来促进其降解。GS激动剂可以有效改善KAL-TG小鼠的突触可塑性及记忆认知功能;传统降脂药物非诺贝特具有下调Kallistatin、上调GS,延缓小鼠记忆认知功能下降的效果。本研究为临床上早期预防和治疗AD提供了新的理论依据和干预靶点。

以上研究得到科技部国家重点研发计划、国家自然科学基金委等项目资助。该研究与蒋斌教授团队合作,李勃兴教授提供指导帮助,得到中山大学实验动物中心、医科公共平台(广州校区)的大力支持。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


