糖,还是脂肪?黄波团队发表Science论文,揭开肝脏能量储存的优先级与机制
来源:生物世界 2024-02-18 10:18
在肝脏细胞中,糖原合成的中间代谢物UDPG可以促进S1P蛋白酶的活性,阻止SREBP的切割活化,从而抑制脂肪酸的从头合成。
中国医学科学院基础医学研究所黄波团队在 Science 期刊发表了题为:Hepatic glycogenesis antagonizes lipogenesis by blocking S1P via UDPG 的研究论文。
该研究表明,在肝细胞中,葡萄糖被优先以糖原形式储存,而不是脂肪。该研究显示,一种糖原合成的中间代谢物——尿苷二磷酸葡萄糖(UDPG),可以运输到肝细胞的高尔基体,在那里它与S1P蛋白酶结合,抑制S1P介导的胆固醇调节元件结合蛋白(SREBP)的切割,从而抑制脂肪合成,促进糖原合成。

糖原和脂肪是细胞用来储存能量的两种基本形式,两者的一个主要区别在于分解时活性氧(ROS)的变化。糖原分解通过磷酸戊糖途径促进NADPH的产生来增强ROS的清除,而脂肪需要氧化降解导致ROS的生成。
值得注意的是,ROS是导致代谢失调的一个潜在驱动因素,ROS升高有可能扰乱细胞的氧化还原平衡,损害蛋白质、DNA和RNA等生物大分子。更重要的是,已有研究证实,ROS在肥胖和衰过程中都会增加。因此,通过脂肪合成储存葡萄糖可能构成潜在的风险,ROS水平的升高有助于脂肪变性,并进一步诱发非酒精性脂肪肝(NAFLD)。
因此,黄波团队推测,为了避免ROS升高带来的诸多危害,肝细胞可能优先使用糖原来存储葡萄糖。在这项发表于 Science 的研究中,研究团队首先假设糖原合成的优先级是通过拮抗脂肪合成来实现的。
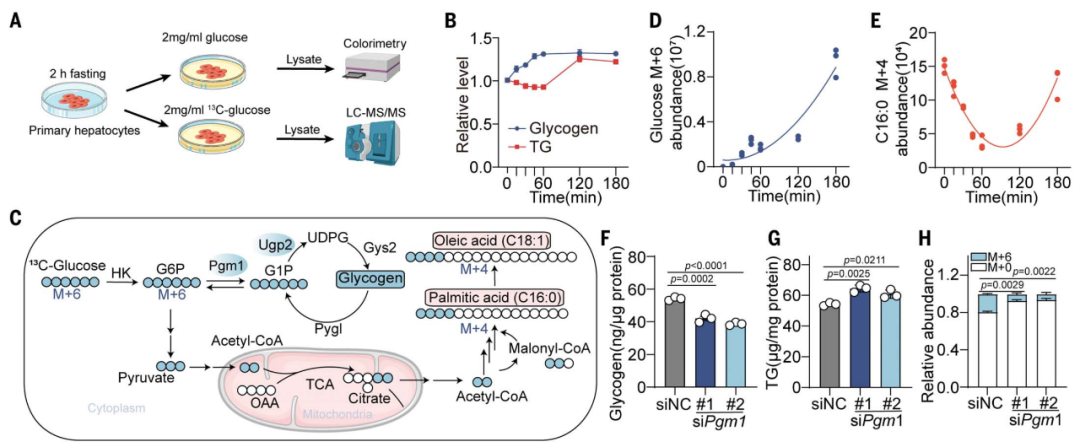
糖原合成可拮抗肝细胞中的脂肪生成
研究团队发现,在原代肝细胞中,葡萄糖在脂肪生成前会优先流入糖原合成途径,当糖原合成酶失活或敲低时,优先级转向了脂肪合成。这一现象证明了研究团队此前的假设,也就是糖原合成和脂肪合成存在拮抗关系,并且前者的优先级更高。
接下来,研究团队通过免疫共沉淀、点击化学、液相色谱-串联质谱(LC-MS/MS)和药物亲和反应靶标稳定性分析,证明了糖原合成的关键中间代谢物——尿苷二磷酸葡萄糖(UDPG),可以与一种名为S1P的蛋白酶直接结合。S1P可以切割高尔基体中的胆固醇调节元件结合蛋白(SREBP),产生其活性形式,后者进入细胞核并促进脂肪合成相关基因的表达。
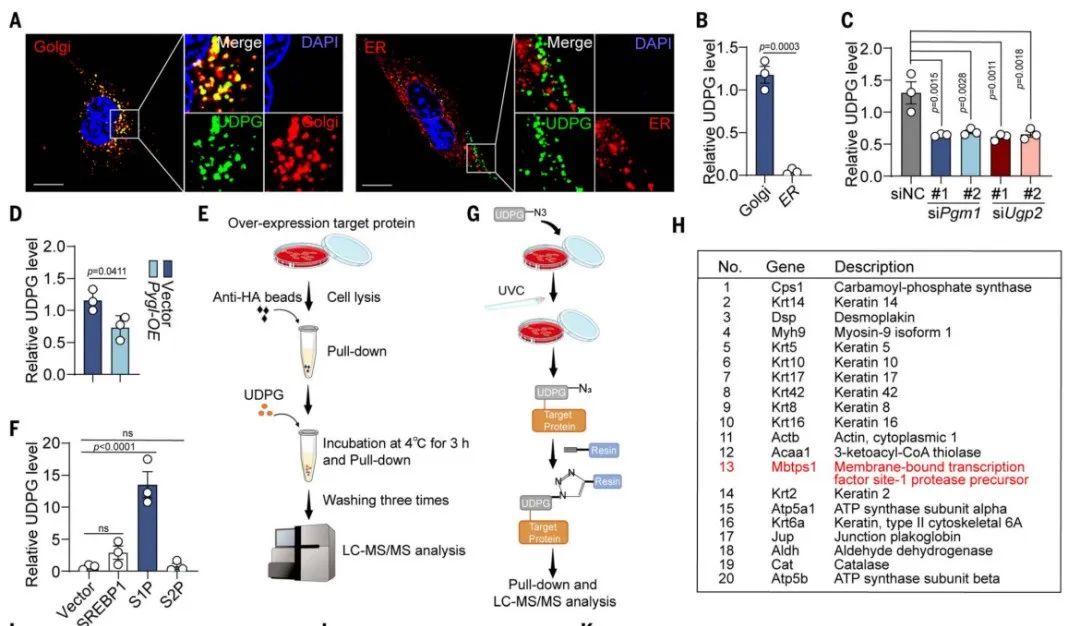
UDPG通过结合S1P来阻断SREBP的切割活化
这种结合并没有改变S1P的mRNA的表达,但确实下调了其在肝细胞中的蛋白水平。通过分子对接、点突变分析和圆二色光谱分析,研究团队进一步证明了S1P的Asn438位点是UDPG结合所必需的。两者结合后,S1P的构象发生改变,导致S1P通过泛素蛋白酶体途径降解。
简而言之,这一过程可以总结为一条拮抗信号通路:糖原合成→产生UDPG→促进S1P降解→阻止SREBP的切割活化→抑制脂肪合成。
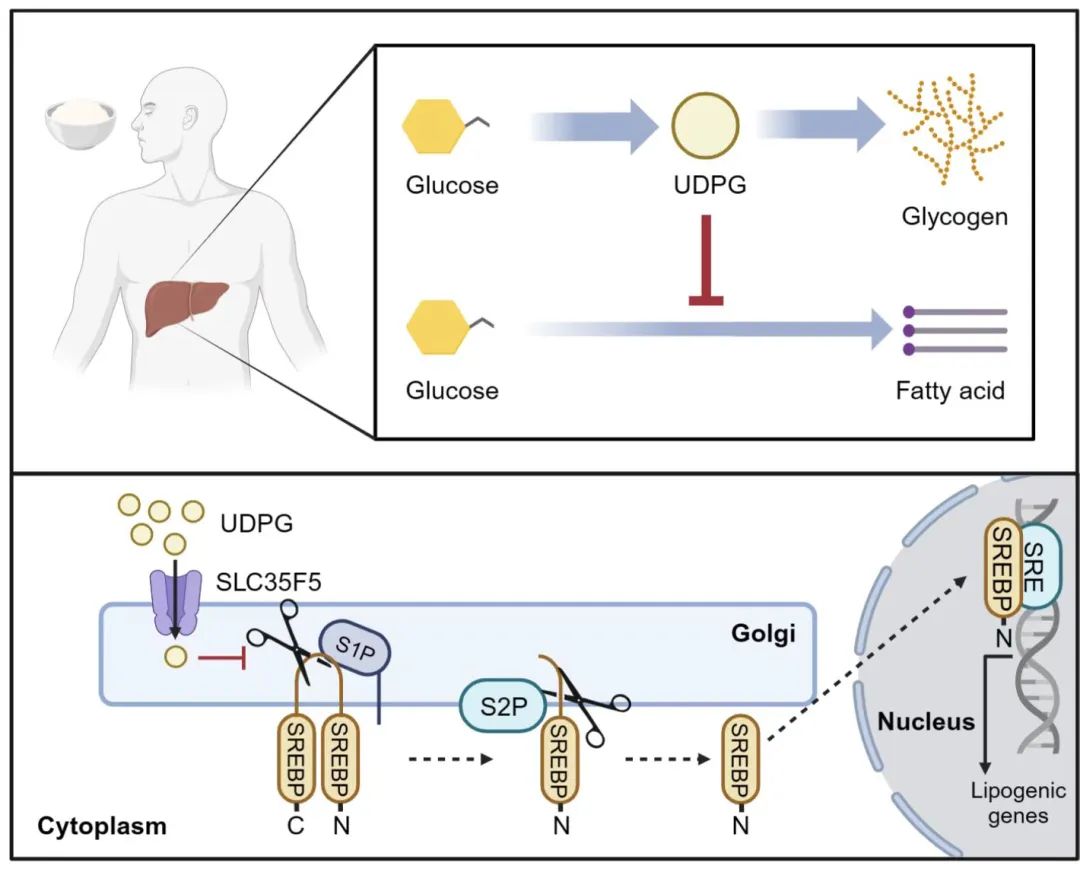
糖原合成拮抗脂肪合成的信号通路的模式图
此外,研究团队还发现,SLC35F5是介导UDPG进入高尔基体的转运体,给高脂肪饮食(HFD)小鼠外源注射UDPG可导致脂肪合成基因的下调,预防因脂肪氧化分解导致的ROS升高,减轻肝脏脂肪变性的发生。与之相印证,在非酒精性脂肪性肝病(NAFLD)患者的原代肝细胞和组织中也观察到一致的结果,强调了这些发现的转化价值。
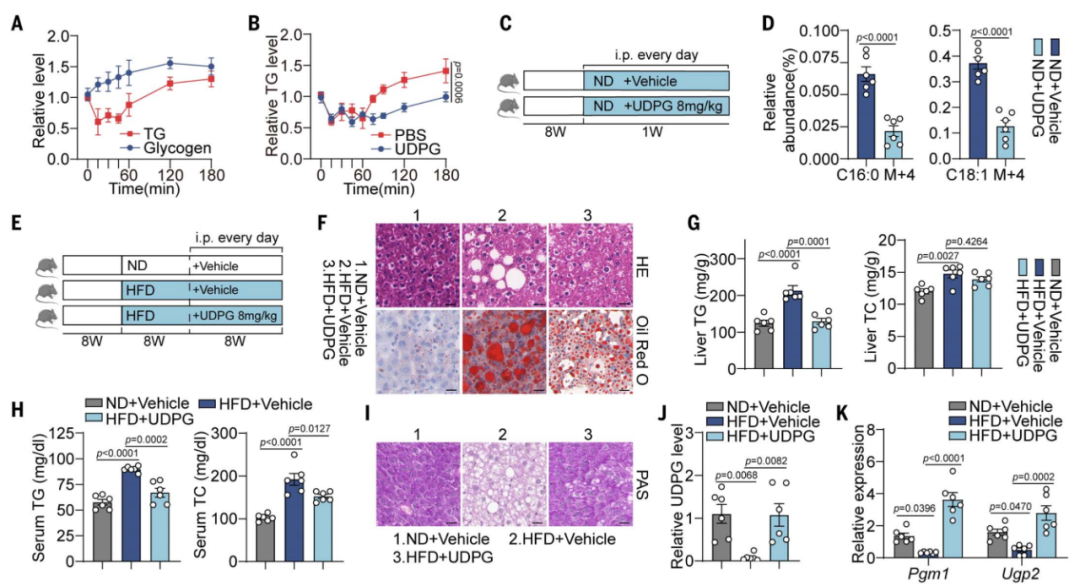
外源注射UDPG可减轻高脂饮食小鼠的肝脂肪变性
总而言之,这项发表于 Science 期刊研究表明,在肝脏细胞中,糖原合成的中间代谢物UDPG可以促进S1P蛋白酶的活性,阻止SREBP的切割活化,从而抑制脂肪酸的从头合成。这种代谢调节的识别,可能也发生在其他糖原产生细胞中——例如产生肌糖原的肌肉细胞。
这一发现为肝细胞如何精确调节糖类和脂质的储存提供了新见解。在临床应用上,这种UDPG介导的脂肪合成调节可能为非酒精性脂肪肝等人类脂质代谢异常疾病的治疗开辟新道路。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


