数字孪生细胞实验室横空出世!Cell:AI + 语法模型破解癌症与大脑发育的动态密码
来源:生物谷原创 2025-07-31 10:48
这项研究不仅打破了计算建模的技术壁垒,更让 "虚拟细胞实验" 从科幻走向现实。
在癌症研究中,每当科学家想测试一种新药的效果,往往需要经历漫长的细胞培养、动物实验,成本高昂且周期漫长。
而如今,一项发表在《细胞》(Cell)杂志上的突破性研究,或许能改变这一现状——来自印第安纳大学、约翰霍普金斯大学医学院等机构的团队开发出一套 "细胞行为语法",让计算机能像理解人类语言一样解读细胞动态,在虚拟环境中构建 "数字孪生" 细胞实验室,提前模拟从肿瘤生长到大脑皮层形成的复杂过程。

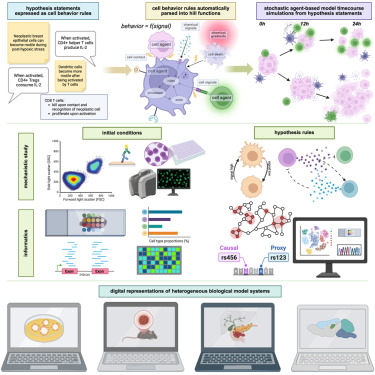
过去,用计算机模拟细胞行为是个"技术活"。即便是简单的肿瘤生长模型,也需要研究者精通数学方程和编程代码,往往数月才能完成建模。而新研究的核心突破,是为细胞行为制定了一套"人类可读语法"——就像用自然语言写句子一样,科学家只需输入 "氧气减少会让肿瘤细胞变得更具运动性" 这类规则,程序就能自动将其转化为数学模型,驱动虚拟细胞的行为。
这套语法构建在名为 PhysiCell 的开源软件框架上。软件中的"代理"(agents)就像一个个"数字细胞",它们遵循的规则映射了真实细胞的 DNA、RNA 指令,能模拟细胞分裂、迁移、与其他细胞或药物的相互作用等复杂行为。例如,在模拟肿瘤微环境时,"代理" 可以根据氧气浓度变化切换状态:低氧时变得更具侵袭性,高氧时则恢复静止。
"过去编写模型代码需要数月,现在两小时就能教会生物学家搭建基础免疫学模型。"印第安纳大学工程学教授 Paul Macklin 表示。更关键的是,这套语法能直接对接单细胞测序、空间转录组学等数据,让虚拟模型与真实组织的细胞分布、功能高度匹配。
虚拟实验室的 "实战成果"
研究团队在多个场景中验证了这套模型的实力,从肿瘤进展到神经发育,展现出广泛的应用潜力。
在胰腺癌研究中,模型模拟了癌症相关成纤维细胞(CAFs)的 "双重角色":一方面,CAFs 分泌的信号会促使胰腺癌细胞从上皮型转化为更具侵袭性的间充质型;另一方面,密集的 CAFs 又会形成物理屏障,阻碍肿瘤扩散。通过输入患者的空间转录组数据,模型能精准复现肿瘤微环境的结构,并预测不同 CAF 密度下肿瘤的侵袭速度——这与患者来源的类器官实验结果高度一致。
而在乳腺癌模型中,研究人员解开了一个关键谜题:免疫细胞中的巨噬细胞如何促进肿瘤侵袭?过去认为,巨噬细胞分泌的 EGF(表皮生长因子)会通过 EGFR 通路促进癌细胞增殖("生长假说"),但模型模拟发现,EGF 更可能通过增强癌细胞的运动能力("迁移假说")驱动侵袭。后续实验证实,用 EGFR 抑制剂处理乳腺癌细胞后,侵袭性突起明显减少,而增殖仅在极高药物浓度下受影响——完美验证了虚拟实验的预测。
甚至在大脑发育领域,模型也展现出惊人能力。利用艾伦脑图谱(Allen Brain Atlas)的数据,团队模拟了小鼠大脑皮层各层的形成过程:神经干细胞通过不对称分裂产生不同类型的神经元,这些细胞按时间顺序迁移并形成分层结构。通过调整分裂速度、迁移规则等参数,模型能精准复现躯体感觉皮层和听觉皮层的独特层状结构,为研究神经发育疾病提供了新工具。
数字孪生 + AI
这项技术的终极目标,是构建能反映个体特征的"数字孪生"模型。例如,通过输入患者肿瘤的免疫细胞组成、基因突变等数据,虚拟实验室可以提前测试不同免疫疗法组合的效果,预测哪种方案最可能抑制肿瘤生长。
在一项模拟胰腺癌免疫治疗的实验中,团队基于患者单细胞测序数据,测试了 GVAX 疫苗、PD-1 抑制剂(Nivolumab)和 CD137 激动剂(Urelumab)的不同组合。结果发现, triple 组合(三种疗法联用)能将更多 T 细胞转化为 "高效杀伤态",但部分患者因巨噬细胞数量不足,反而对双药组合反应更好——这为个性化治疗方案的选择提供了依据。
目前,团队正尝试将人工智能与这套语法结合,让模型能自动从新数据中学习并更新规则。"未来,研究者可以先在虚拟实验室中筛选最有潜力的假说,再在真实实验中验证——这将大幅加速生物发现的速度。" 约翰霍普金斯大学医学院 Genevieve Stein-O'Brien 博士说。
这项研究不仅打破了计算建模的技术壁垒,更让 "虚拟细胞实验" 从科幻走向现实。或许在不久的将来,每个患者都能拥有专属的 "数字孪生",让癌症等疾病的治疗不再依赖 "试错",而是精准如导航系统般直达最优解。(生物谷Bioon.com)
参考文献:
Jeanette A.I. Johnson et al., Human interpretable grammar encodes multicellular systems biology models to democratize virtual cell laboratories, Cell (2025). DOI: 10.1016/j.cell.2025.06.048.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


