Cancer Cell :颜鹏泽等揭示Midkine是乳腺衰老和肿瘤发生的驱动因素
来源:生物探索 2024-10-08 14:22
该研究不仅揭示了Midkine在衰老及乳腺肿瘤发生中的重要作用,还为未来的临床研究提供了新的视角与可能性。
衰老是癌症的重要风险因素,大多数肿瘤的确诊发生在50岁以上的个体 【1】。乳腺癌是女性中最常见的癌症,平均确诊年龄为62岁【2】,然而,目前针对老龄动物模型的研究仍然相对有限,且老年患者在临床试验中的代表性不足,导致我们对衰老相关肿瘤机制的理解存在空白。尽管组织学、乳腺影像学、细胞及分子生物学分析已经揭示了人类和小鼠乳腺组织在衰老过程中发生的显著变化,但这些变化在乳腺肿瘤发生中的功能性作用仍未得到明确阐明【3-5】。
这一领域的深入研究对于揭示肿瘤发生的潜在机制,并为乳腺癌的早期干预提供新的方向,具有重要意义。为此,2024年10月3日,哈佛医学院Dana-Farber癌症研究所Kornelia Polyak团队(颜鹏泽博士为该研究的第一作者)在Cancer Cell在线发表题为Midkine as a driver of age-related changes and increase in mammary tumorigenesis的研究论文。
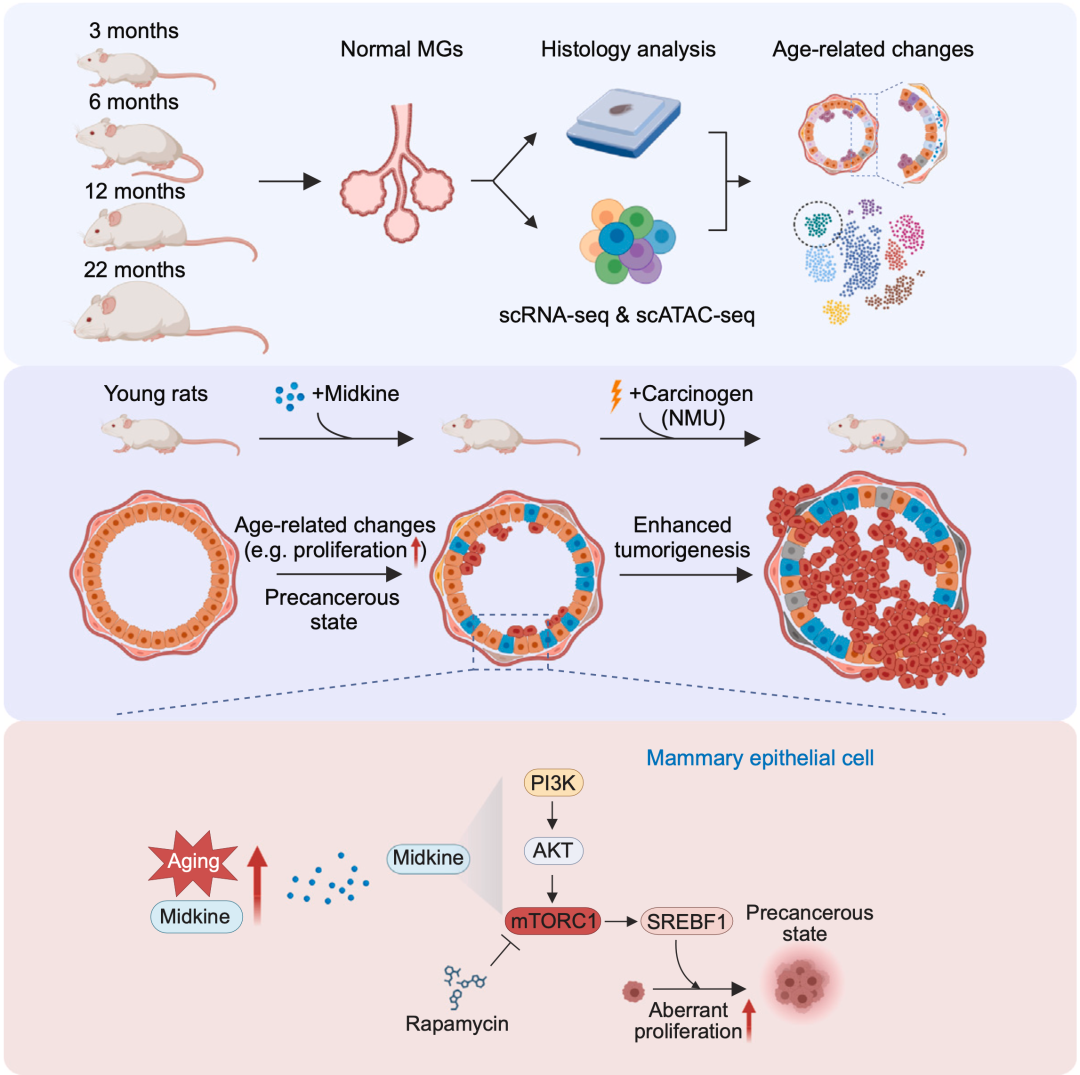
研究系统揭示了中期因子(MDK,Midkine)在介导乳腺衰老及肿瘤发生中的重要作用,探讨了其潜在的机制与临床意义。

该研究首先通过单细胞多组学测序和组织学分析,对不同年龄的大鼠乳腺组织进行了详细分析,发现随着年龄增长,乳腺组织内的细胞组成和分子特征发生了显著变化。研究团队观察到,老年大鼠中上皮细胞出现异常增殖,并且出现一群具有癌变特征的管腔祖细胞(Aging-LP)。同时,乳腺组织中原始B细胞和T细胞的比例下降,这表明随着年龄的增长,乳腺微环境向更易致癌的状态转变。重点研究发现,Midkine在老年大鼠和人类的乳腺上皮细胞中显著上调,并且在年轻大鼠(1月龄)中进行为期一个月的Midkine处理后,其乳腺组织表现出类似于衰老大鼠(22月龄)的特征。具体来说,Midkine通过激活PI3K-AKT-SREBF1信号通路,导致了乳腺上皮细胞的异常增殖和Aging-LP的出现。这一发现为理解Midkine如何驱动衰老相关肿瘤提供了重要线索。
研究团队在实验中还利用了NMU(N-亚硝基-N-甲基脲)诱导大鼠乳腺肿瘤模型,该模型具有与人类雌激素受体阳性(ER+)乳腺癌高度相似的组织病理特征,并且保留了完整的免疫系统,适合研究肿瘤微环境及宿主-肿瘤相互作用,广泛用于乳腺癌机制研究和药物筛选【6】。基于该模型的实验结果表明,Midkine处理的年轻大鼠比对照组更容易形成肿瘤,且肿瘤生长速率更快。这一发现进一步证明了Midkine在肿瘤发生过程中的关键角色,提示其可能作为预防与治疗肿瘤的新靶点。
进一步的分析表明,健康个体的血浆中Midkine水平与年龄呈正相关,这表明Midkine可能作为一种新型衰老生物标志物。Midkine也在多种人类癌症类型中显著上调,包括乳腺癌。与正常乳腺组织相比,DCIS(导管内癌)和IBC(侵袭性乳腺癌)患者样本中的Midkine水平显著升高。此外,年轻HR+(激素受体阳性)乳腺癌患者中,MDK表达较高的患者其疾病特异性生存期明显缩短,这表明MDK可以作为HR+乳腺癌中的一个与年龄相关的预后标志物。在年轻健康女性中,正常乳腺组织中较高的MDK表达与更高的乳腺癌风险相关,暗示MDK也是一个与年龄相关的乳腺癌风险预测因子。
总体而言,该研究不仅揭示了Midkine在衰老及乳腺肿瘤发生中的重要作用,还为未来的临床研究提供了新的视角与可能性。研究成果为理解衰老相关肿瘤的发病机制和发展新的干预策略奠定了基础,具有重要的生物学和临床应用价值。
模式图(Credit: Cancer Cell)
1. Peto, J. (2001). Cancer epidemiology in the last century and the next decade. Nature 411, 390-395. 10.1038/35077256.
2. Bidoli, E., Virdone, S., Hamdi-Cherif, M., Toffolutti, F., Taborelli, M., Panato, C., and Serraino, D. (2019). Worldwide Age at Onset of Female Breast Cancer: A 25-Year Population-Based Cancer Registry Study. Sci Rep 9, 14111. 10.1038/s41598-019-50680-5.
3. Gray, G.K., Li, C.M., Rosenbluth, J.M., Selfors, L.M., Girnius, N., Lin, J.R., Schackmann, R.C.J., Goh, W.L., Moore, K., Shapiro, H.K., et al. (2022). A human breast atlas integrating single-cell proteomics and transcriptomics. Dev Cell 57, 1400-1420.e1407. 10.1016/j.devcel.2022.05.003.
4. Reed, A.D., Pensa, S., Steif, A., Stenning, J., Kunz, D.J., Porter, L.J., Hua, K., He, P., Twigger, A.J., Siu, A.J.Q., et al. (2024). A single-cell atlas enables mapping of homeostatic cellular shifts in the adult human breast. Nat Genet 56, 652-662. 10.1038/s41588-024-01688-9.
5. Pelissier Vatter, F.A., Schapiro, D., Chang, H., Borowsky, A.D., Lee, J.K., Parvin, B., Stampfer, M.R., LaBarge, M.A., Bodenmiller, B., and Lorens, J.B. (2018). High-Dimensional Phenotyping Identifies Age-Emergent Cells in Human Mammary Epithelia. Cell Rep 23, 1205-1219. 10.1016/j.celrep.2018.03.114.
6. Gil Del Alcazar, C.R., Trinh, A., Aleckovic, M., Rojas Jimenez, E., Harper, N.W., Oliphant, M.U.J., Xie, S., Krop, E.D., Lulseged, B., Murphy, K.C., et al. (2022). Insights into Immune Escape During Tumor Evolution and Response to Immunotherapy Using a Rat Model of Breast Cancer. Cancer Immunol Res 10, 680-697. 10.1158/2326-6066.CIR-21-0804.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


