《癌症研究》:仁济医院团队揭示二甲双胍抗肠癌新机制!通过干预色氨酸代谢重塑免疫微环境!
来源:奇点糕 2023-06-14 08:48
仁济医院团队开展的本次研究,揭示了二甲双胍调节肠癌细胞色氨酸代谢的全新机制,进一步解释了二甲双胍重塑肠癌免疫微环境,特别是增强CD8+T细胞免疫功能的作用,至于如何更好地从色氨酸代谢入手调节抗肿瘤免疫
二甲双胍这款“老牌神药”的抗癌功效,各位这几年肯定都听过不少,但其实二甲双胍最确切的抗癌功效之一,早在2016年就被证实:一项临床III期随机对照研究显示,低剂量服用二甲双胍1年,能有效降低结直肠癌癌前病变发生率[1]。
学界普遍认为,二甲双胍抗肠癌的功效与其增强抗肿瘤免疫有关,上海交通大学医学院附属仁济医院消化内科杜婉、熊华团队,近期就在知名期刊Cancer Research上发表最新研究,揭示了“神药”正向调控肠癌免疫微环境的新机制。
研究者们发现,二甲双胍能通过下调MYC基因表达,抑制结直肠癌细胞的色氨酸摄取能力,帮CD8+T细胞从癌细胞口中抢走更多色氨酸,从而重塑肠癌免疫微环境,扩增CD8+T细胞数量并增强其细胞毒性,助力抗肿瘤免疫应答[2]。

论文首页截图
既往已有研究显示,二甲双胍可调节肿瘤微环境中癌细胞和免疫细胞的葡萄糖、脂肪酸代谢[3-4],那么同为三大营养物质,二甲双胍是否会影响组成蛋白质的氨基酸代谢呢?要知道,T细胞如果摄取不到足够的氨基酸,在抗肿瘤免疫时的“打工”状态也会受影响[5],如果二甲双胍能在这方面出把力就太好了。
基于上述假设和既往研究经验,仁济医院研究团队对小鼠正常结肠组织开展了单细胞测序,发现CD8+T细胞在二甲双胍处理组小鼠的肠道中显著增多,而CD4+T细胞较对照组减少,同时B细胞和髓系细胞组分也有一定的改变。
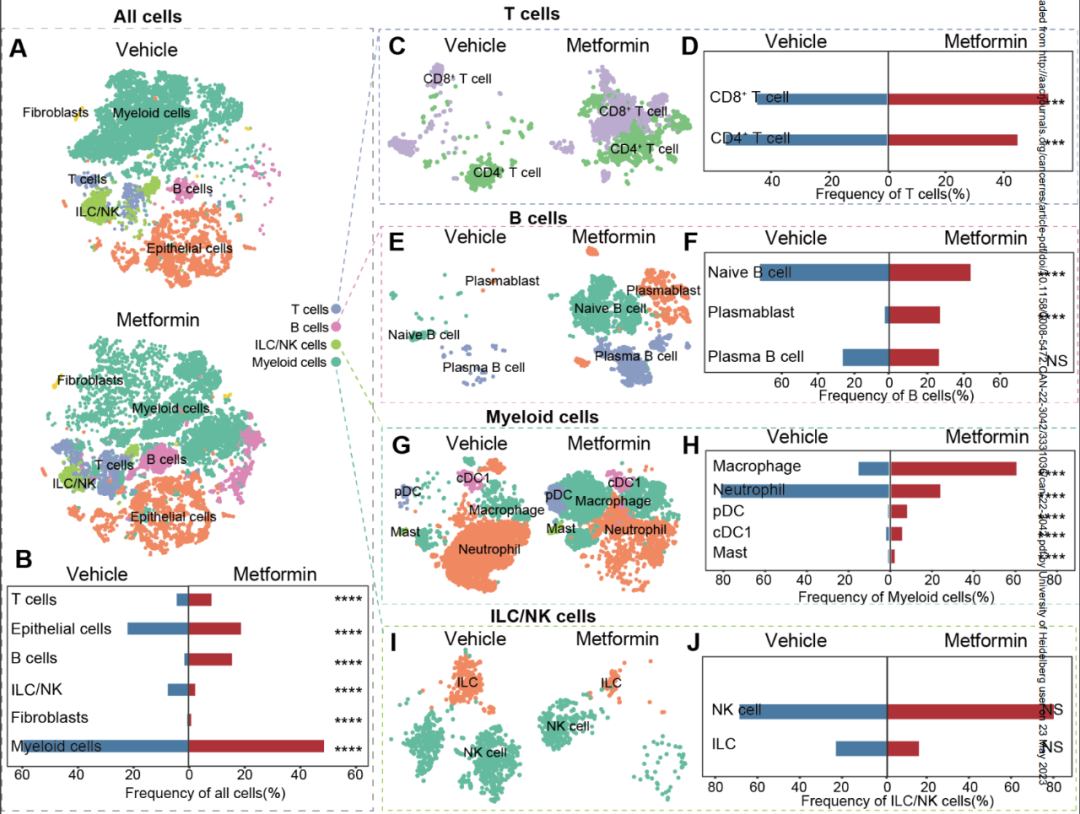
二甲双胍对免疫细胞占比的影响
这些发现能再次确认二甲双胍重塑肠道免疫微环境的作用,接下来的重点是找到具体的作用机制。基因集富集分析(GSEA)显示,二甲双胍处理后肠上皮细胞和CD8+T细胞的氨基酸代谢状况存在显著差异,甚至可以说背道而驰。
研究团队以此为线索进一步分析,发现在二甲双胍处理后,代谢重编程最显著的就是CD8+T细胞对色氨酸的代谢上升,肠上皮细胞的色氨酸代谢受到抑制;而相比正常肠上皮细胞,结直肠癌细胞对色氨酸的代谢也明显增强。
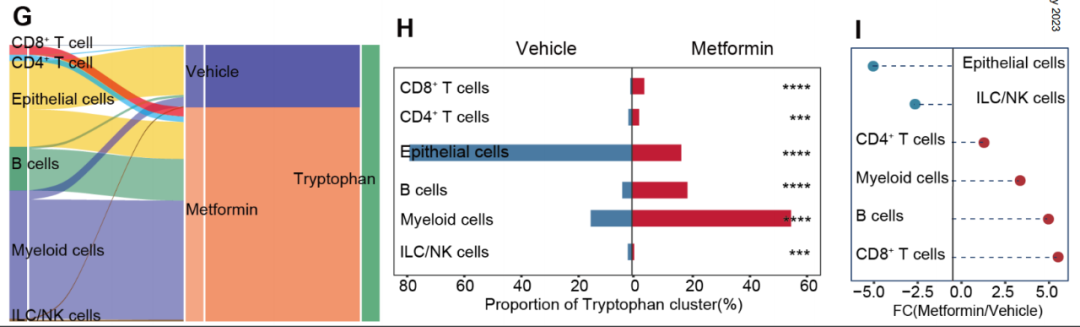
二甲双胍在正常肠道中对不同细胞色氨酸代谢的影响
看来在肠癌环境下,癌细胞和CD8+T细胞肯定会为争夺色氨酸打得不可开交,研究团队的实验也证实了该假设,并发现CD8+T细胞明显争不过癌细胞,但二甲双胍处理就能够逆转战局,帮CD8+T细胞争到更多的色氨酸。
在“外援”助力下获取更多色氨酸后,CD8+T细胞释放颗粒酶B、干扰素-γ(IFN-γ)和肿瘤坏死因子-α(TNF-α)的能力显著增强,意味着它们的细胞毒性被有效恢复,而且实验也证实二甲双胍的这种效应是色氨酸依赖性的。
二甲双胍是怎么帮CD8+T细胞争取到更多的色氨酸呢?研究团队分析了肠癌及正常肠道组织中色氨酸转运蛋白的mRNA表达情况,发现与正常肠道组织相比,肠癌细胞中转运蛋白SLC7A5的表达显著上调,且表达水平与肠癌患者临床分期、淋巴结及远处转移情况相关,敲除SLC7A5就可有效改善CD8+T细胞的功能。
换句话说,SLC7A5与肠癌细胞的色氨酸代谢高度相关,它也正是二甲双胍的作用目标:在二甲双胍处理后,肠癌细胞高表达的SLC7A5就显著减少;更进一步的分析显示,二甲双胍可显著下调MYC基因表达,从而减少MYC蛋白与SLC7A5基因的启动子部位结合,抑制SLC7A5基因的表达水平,进而干预色氨酸代谢。
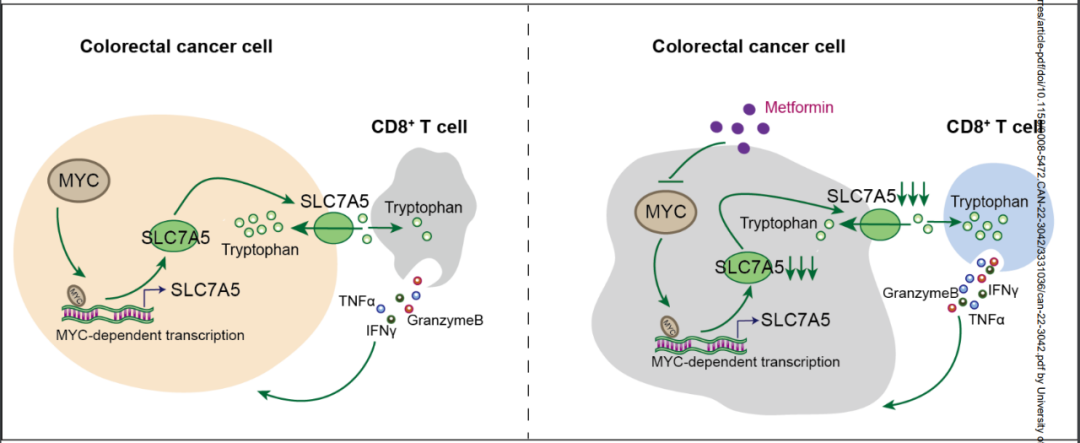
二甲双胍通过下调MYC抑制SLC7A5基因表达,影响色氨酸代谢
总而言之,仁济医院团队开展的本次研究,揭示了二甲双胍调节肠癌细胞色氨酸代谢的全新机制,进一步解释了二甲双胍重塑肠癌免疫微环境,特别是增强CD8+T细胞免疫功能的作用,至于如何更好地从色氨酸代谢入手调节抗肿瘤免疫,用好二甲双胍这款老牌“神药”,就期待研究成果尽快向临床实践转化吧。
参考文献:
[1]Higurashi T, Hosono K, Takahashi H, et al. Metformin for chemoprevention of metachronous colorectal adenoma or polyps in post-polypectomy patients without diabetes: a multicentre double-blind, placebo-controlled, randomised phase 3 trial[J]. The Lancet Oncology, 2016, 17(4): 475-483.
[2]Huang X, Sun T, Wang J, et al. Metformin reprograms tryptophan metabolism to stimulate CD8+ T cell function in colorectal cancer[J]. Cancer Research, 2023: CAN-22-3042.
[3]Uehara T, Eikawa S, Nishida M, et al. Metformin induces CD11b+-cell-mediated growth inhibition of an osteosarcoma: implications for metabolic reprogramming of myeloid cells and anti-tumor effects[J]. International Immunology, 2019, 31(4): 187-198.
[4]Xiong W, Sun K Y, Zhu Y, et al. Metformin alleviates inflammation through suppressing FASN-dependent palmitoylation of Akt[J]. Cell Death & Disease, 2021, 12: 934.
[5]Campesato L F, Budhu S, Tchaicha J, et al. Blockade of the AHR restricts a Treg-macrophage suppressive axis induced by L-Kynurenine[J]. Nature communications, 2020, 11: 4011.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


