生物谷推荐:4月必看的重磅级研究Top10
来源:本站原创 2021-04-30 17:19
转眼间4月份已经接近尾声了,这个月又有哪些亮点研究值得我们深入学习一下呢?小编根据本月新闻的类型、热度和研究领域筛选出了本月的重磅级研究Top10,与大家一起学习。【1】Nat Biomed Eng:将癌症连根拔起!特殊双网凝胶或能将癌细胞重编程转换为癌症干细胞 有望开发新型抗癌疗法!doi:10.1038/s41551-021-00692-2癌症的复发常常
转眼间4月份已经接近尾声了,这个月又有哪些亮点研究值得我们深入学习一下呢?小编根据本月新闻的类型、热度和研究领域筛选出了本月的重磅级研究Top10,与大家一起学习。
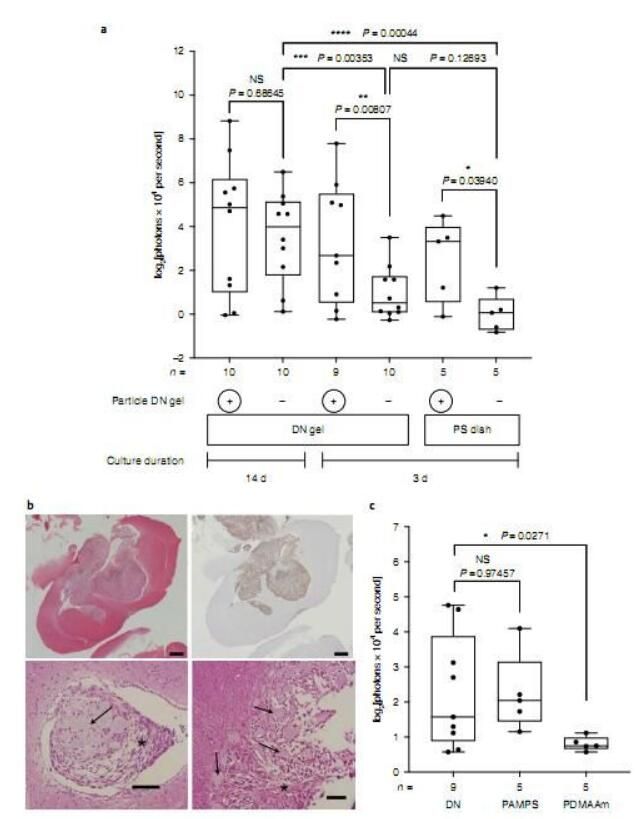
体内DNA凝胶诱导的球形脑部癌细胞的致瘤潜力
图片来源:Suzuka, J., et al. Nat Biomed Eng (2021). doi:10.1038/s41551-021-00692-2
【1】Nat Biomed Eng:将癌症连根拔起!特殊双网凝胶或能将癌细胞重编程转换为癌症干细胞 有望开发新型抗癌疗法!
doi:10.1038/s41551-021-00692-2
癌症的复发常常是因为罕见的循环癌症干细胞(CSCs,circulating cancer stem cells)对化疗和放疗产生耐受性所致。日前,一篇发表在国际杂志Nature Biomedical Engineering上题为“Rapid reprogramming of tumour cells into cancer stem cells on double-network hydrogels”的研究报告中,来自北海道大学等机构的科学家们通过对6种不同的人类癌细胞类型进行研究,成功在24小时内将癌细胞转换回了癌症干细胞,相关研究结果或有望帮助开发新型抗癌干细胞药物和个体化疗法。
癌症干细胞需要一种非常特殊的微环境,这篇研究报告中,研究人员调查了是否DN凝胶(双网凝胶,double-network hydrogel)能够重现这种合适的环境来诱导癌症干细胞,DN凝胶由两种化学物质组成的网络,其中含有大量的水分,这就赋予了DN凝胶具有类似生物组织的柔软和湿润特性。研究者发现,DN凝胶能在24小时内将6种不同类型的人类癌细胞系的癌细胞重编程使其分化为癌症干细胞;这6种类型的癌症包括脑癌、子宫癌、肺癌、结肠癌、膀胱癌和肉瘤。当将癌细胞置于DN凝胶上时,其就会开始形成球状结构并产生癌症干细胞的特殊分子标志物,比如SOX2和Oct3/4和Yamanaka因子等,这就指示,这些癌细胞发生了重编程。
研究者Shinya Tanaka说道,本文研究为开发靶向作用癌症干细胞的新型药物提供了新的思路;未来DN凝胶或能用来帮助进行癌细胞类型的诊断并帮助开发新型个体化疗法来治疗并改善多种癌症患者的预后。
综上所述,研究人员发现,名为双网凝胶(DN凝胶)的特殊凝胶能将6种类型癌细胞快速重编程为癌症干细胞,且当癌细胞在DN凝胶上生长时,其会形成球状结构并产生诸如SOX2和Oct3/4等指示癌症干细胞的特殊分子标志物。而且,钙离子通道受体和骨桥蛋白对于调节DN凝胶所介导的脑癌细胞干性的诱导非常重要,而且利用相应的受体制剂就能抑制并剔除相应的癌症干细胞。
【2】Science子刊:肿瘤无处逃!临床前研究表明三特异性duoCAR-T细胞可有效治疗抗原异质性癌症
doi:10.1126/scitranslmed.abc6401
在一项新的研究中,Lentigen研究人员让表达靶向CD19和CD20的串联CAR的慢病毒载体转导原代CD4+ T细胞和CD8+ T细胞,所表达的串联CAR通过P2A自切割肽与靶向CD22抗原的monoCAR操作性连接在一起,据此开发出三特异性duoCAR-T 细胞,并评估了这种三特异性duoCAR-T 细胞解决抗原逃逸问题的能力。相关研究结果近期发表在Science Translational Medicine期刊上,论文标题为“Trispecific CD19-CD20-CD22–targeting duoCAR-T cells eliminate antigen-heterogeneous B cell tumors in preclinical models”。
研究人员构建出4种duoCAR构建体(称为D1、D2、D3和D4),每个构建体的两个开放阅读框都被一个P2A肽隔开,它们在T细胞表面上的表达谱如图1所示。DuoCAR D1由靶向B细胞抗原CD19和CD20的串联单链可变区片段(scFv)结合结构域、来源于CD8的铰链和跨膜结构域、ICOS共刺激结构域、CD3激活结构域以及位于CD3激活结构域之后的第一代靶向CD22的CAR基因、来源于CD8的铰链和跨膜结构域、CD3激活结构域组成。D2与D1相同,只是用OX40结构域代替了ICOS共刺激结构域。D3含有与构建体D2相同的靶向CD19和CD20的串联CAR基因,该串联CAR基因后面是一个靶向CD22的 CAR基因、第二代ICOS共刺激结构域和CD3激活结构域。D4含有靶向CD20和CD19的串联CAR基因和CD27共刺激结构域,还含有靶向CD22的CAR基和ICOS共刺激结构域,此外每个共刺激结构域后面是一个CD3激活结构域。
这项研究在体外和体内证实了duoCAR-T细胞的高功能性。这种方法广泛解决了抗原异质性的紧迫问题。此外,这些作者发现了一个未预料到的不包括CD28或4-1BB结构域的最佳共刺激结构域的组合,这表明科学家们对与高活性和长期持久性相关的T细胞信号转导的理解仍在继续完善。在CAR-T方法被认为得到真正优化之前,必须考虑到激活(由CD3磷酸化可知)、长期持续性(由Akt激活所示)以及对通常由细胞因子介导的生理信号作出的反应(比如STAT5磷酸化)。此外,从p38和Erk1/2磷酸化来看,duoCAR中一些激活信号的减少表明,最大的初始激活可能与疾病控制不相关。这项研究开发的duoCAR-T细胞方法在当前CAR-T细胞疗法的基础上进行了改进,克服了肿瘤异质性和肿瘤抗原逃逸的临床挑战,同时保较高的抗肿瘤效力和持久性。
【3】EMBO Mol Med:重磅!科学家开发出能有效阻断HIV再度激活的纳米酶!
doi:10.15252/emmm.202013314
在机体感染期间,活性氧(ROS,Reactive oxygen species)能调节人类免疫缺陷病毒1型(HIV-1)的复制,然而,由于操纵细胞中抗氧化系统所产生的有害结果,将这一研究观点应用于开发新型HIV治疗策略目前仍然处于滞后阶段。日前,一篇刊登在国际杂志EMBO Molecular Medicine上题为“Antioxidant nanozyme counteracts HIV‐1 by modulating intracellular redox potential”的研究报告中,来自印度科学院等机构的科学家们通过研究就成功开发了一种新型人工酶类,其能成功阻断宿主免疫细胞中HIV-1的再度激活和复制。
研究者表示,这种由五氧化二钒纳米片(vanadium pentoxide nanosheets)制成的新型纳米酶(nanozymes)能够模拟天然酶类谷胱甘肽过氧化物酶(glutathione peroxidase)的功能,帮助减少宿主细胞中氧化性压力的水平,而宿主细胞中氧化性压力能够有效控制病毒的增殖。这种新型纳米酶的优势在于其在生物系统中较为稳定,并不会在细胞中介导任何不必要的反应,而且研究人员在实验室中制备这种纳米酶也相对容易一些。
目前科学家们并没有有效的策略来从患者机体中完全消除HIV,而抗HIV药物也仅能成功抑制病毒,并无法从受感染的细胞中完全清除HIV,HIV会以一种潜伏的状态躲避在宿主的免疫细胞中,并且稳定地维持病毒的储存库(reservoir),当诸如宿主细胞中的过氧化氢分子等有毒分子的水平增加时,就会导致细胞中氧化性压力水平增加,这样一来病毒就会被重新激活,从隐藏的地方出来开始再度复制。
将ART与新型纳米酶结合起来或许还能带来其它优势,比如,某些ART药物能够诱发氧化性压力作为副作用,其对于宿主机体的心脏细胞或肾脏细胞都具有一定的损伤效应;而添加了诸如本文中所开发的纳米酶就能减少因ART药物治疗所带来的疗法副作用,同时还能改善接受疗法的HIV患者的生活质量。
尽管在实验室检测中研究人员发现这种新型纳米酶类对宿主机体正常细胞是无害的,但后期他们仍需要深入研究来理解是否将这种纳米酶类引入宿主机体中会产生其它的影响,这些纳米酶类会进入到哪些器官?会在体内停留多长时间?这还需要后期科学家们的进一步研究才能够解答。
综上,研究人员证实了这种五氧化二钒超薄纳米酶在有效阻断HIV-1再度激活即繁殖上的有用性,且这种纳米酶未来有望作为一种新型平台来帮助开发抵御诸如HIV感染等多种人类感染性疾病的干预性策略。
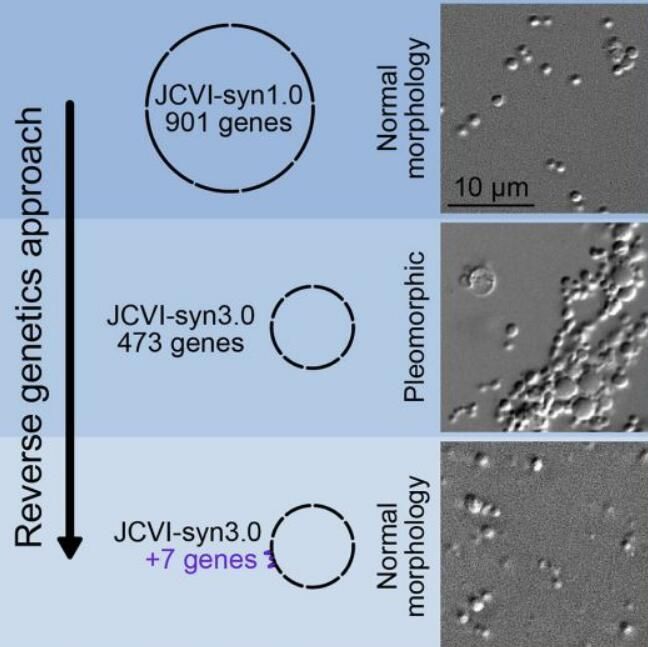
基因组最小的合成细胞发展历程。
图片来源:Cell, 2021, doi:10.1016/j.cell.2021.03.008
【4】重大突破!Cell论文指出仅添加7个基因就可让世界上基因组最小的合成细胞正常分裂和生长
doi:10.1016/j.cell.2021.03.008
5年前,科学家们高调地宣布,他们已经设计出一种精简的微生物细胞,该细胞能够在比任何已知有机体含有更少基因的情形下存活下来。但是这种“基因组最小细胞”常常会出现异常分裂。如今,在一项新的研究中,来自美国国家标准与技术研究院和克雷格-文特尔研究所(J. Craig Venter Institute, JCVI)等研究机构的研究人员通过仅放回7个基因,成功地对这种精简的微生物细胞进行校正,使之像天然的细胞一样生长。相关研究结果于2021年3月29日在线发表在Cell期刊上,论文标题为“Genetic requirements for cell division in a genomically minimal cell”。论文通讯作者为美国国家标准与技术研究院的合成生物学家Elizabeth Strychalski和克雷格-文特尔研究所的John I. Glass。
这一发现可能会使科学家们更加了解哪些功能对正常细胞至关重要,以及这些有机体中的许多神秘基因发挥何种作用。这是向前迈出的重要一步,也许可以帮助确定这些未知基因的功能。确定必需基因也对合成生物学家有利,因为他们正在努力构建细胞或类似细胞的物体,以便生产化学品,感知环境条件,递送药物,并在工业和医学领域执行其他任务。为了恢复生命,科学家们需要知道所需的最少基因清单是什么。基因组最小细胞还可以通过阐明哪些能力是原始细胞所必需的,从而为生命的起源提供新的见解。
通过添加回不同的基因组合来确定所产生的细胞是否正常分裂,这些作者将所需的基因数量缩小到19个,然后进一步缩小。在这项新的研究中,他们发现,他们只需在JCVI-syn3.0中加入7个基因就可以恢复正常的细胞分裂。这7个基因分别是两个已知的细胞分裂基因(ftsZ和sepF)、一个作用底物未知的水解酶和4个编码功能未知的膜相关蛋白的基因。添加这7个基因可让JCVI-syn3.0合成细胞的表型类似于JCVI-syn1.0。这些经过校正的基因组最小细胞可以帮助阐明这个仍然神秘的过程。这些作者指出,他们仍然不知道这些基因组最小细胞的具体分裂机制,这让他们大吃一惊,毕竟这是生命的基本方面之一。
【5】PLoS Pathog:抗碳水化合物抗体2G12交叉中和HIV-1和H3N2病毒,有望作为对抗有包膜RNA病毒的通用抗体
doi:10.1371/journal.ppat.1009407
在一项新的研究中,来自美国、英国和中国台湾的研究人员证实2G12在过去三十年中具有中和人类季节性H3N2病毒的能力,并通过对病毒天然HA蛋白和重组HA蛋白上的N-连接聚糖的结构生物学分析、质谱分析和进化分析来研究中和机制。在HA受体结合位点(RBS)附近的一个保守性的高甘露糖N-连接糖基化位点和一个新获得的高甘露糖N-连接糖基化位点都有助于2G12对流感病毒的这种广泛中和活性。相关研究结果近期发表在PLoS Pathogens期刊上,论文标题为“A cross-neutralizing antibody between HIV-1 and influenza virus”。
添加、去除或替换聚糖屏障的N-糖基化位点是RNA病毒逃避抗体识别的常用策略之一。在这项新的研究中,这些作者证明了2G12尽管作为抗HIV抗体被发现,但也具有广泛中和过去50年发生进化的人H3N2流感病毒的能力。通过全面的和基于进化轨迹的位点特异性糖蛋白组学、突变和负染色电子显微镜(nsEM)成像,他们发现2G12中和H3N2流感病毒是通过与存在于N-糖基化位点N165和N246上的两个高甘露糖聚糖结合实现的,其中这两个位点位于HA受体结合位点的近端。由此看来,2G12很可能代表了一种针对人类流感病毒的中和抗体,它只识别HA表面上的聚糖表位。1980年前后N246的出现使得H3N2流感病毒在N246和N165处赋予了可以被2G12识别的寡甘露糖聚糖簇。那么,这些位点的逃逸突变体很可能具有较高的适应成本,这是因为,保守性N165的破坏会降低病毒的适应能力,而N246位点的破坏在近期的病毒中无法得到拯救。
在这项新的研究中,这些作者揭示了2G12可以中和人类H3N2病毒,这是因为自从1968年大流行以来的H3N2进化过程中,大约30-35年前出现了N246糖基化位点。由于2G12也与HIV-1 Env上的高甘露糖表位结合,这就提出了这样的碳水化合物是否可以作为有包膜RNA病毒表面上的通用表位的问题。迄今为止,大多数针对表位有碳水化合物的病毒的抗体都是在HIV-1慢性感染的患者中发现的。虽然在HIV-1未感染的人类受试者中发现了2G12样Fab二聚化聚糖抗体和前体分子,但进一步的疫苗接种研究将阐明如何诱发2G12样抗碳水化合物抗体来对抗高糖基化的病毒。
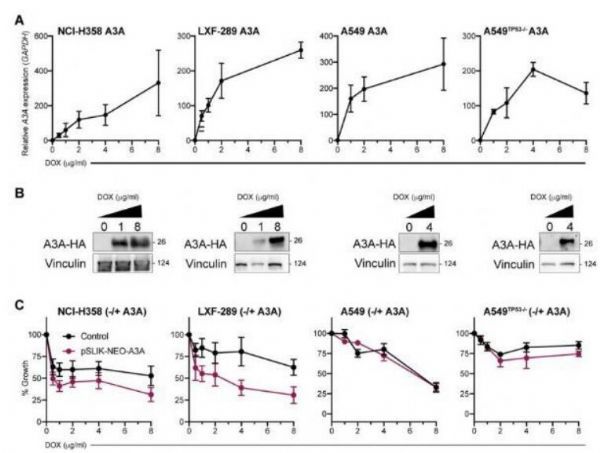
诱导A3A的表达能降低肺腺癌细胞系的适应性。
图片来源:Josep Biayna, et al.bioRxiv (2021). DOI: 10.1101/2021.02.05.429803
【6】bioRxiv:科学家识别出一种有望治疗肺癌的新型潜在靶点
doi:10.1101/2021.02.05.429803
在癌症研究中,个体化医学疗法往往利用了单一肿瘤中特殊的遗传改变来寻找其弱点并对其进行攻击,很多肿瘤都携带有高水平的突变,这或许是因为一种特殊的抗病毒防御机制—APOBEC系统,其能意外地损坏DNA并诱发突变。对癌症突变特征的分析常常会给研究人员提供突变来源的大量信息,并能指导临床疗法的使用,包括免疫疗法等;尤其是,APOBEC3A(A3A,载脂蛋白BmRNA编辑酶催化多肽样蛋白3A,apolipoprotein B mRNA-editing enzyme catalytic polypeptide-like 3A)如今已经成为了癌细胞发生突变的主要驱动因子,其表达会导致DNA的损伤,并会对ATR和CHK1检查点激酶抑制剂疗法变得敏感。
近日,一篇发表在预印版平台bioRxiv上题为“Loss of HMCES is synthetic lethal with APOBEC activity in cancer cell”的研究报告中,来自巴塞罗那科学技术学院等机构的科学家们通过研究发现,名为HMCES的特殊酶类或许一些肺部肿瘤的致命弱点,尤其是携带APOBEC系统所诱发的高水平突变的肺部肿瘤。HMCES是一种与脱碱基位点保护相关的蛋白质,其还能作为对A3A表达耐受的中枢性蛋白。研究者Supek博士指出,阻断酶类HMCES或许会对拥有活性APOBEC系统的细胞(比如很多肺癌细胞)产生很强的破坏性效应,但对于该系统没有激活的细胞却并没有影响,正如在健康细胞中观察到的那样。除了能够展示出对癌细胞的特异性之外,HMCES还能潜在地被药物所靶向作用,这就使其有望成为未来科学家们开发肺癌疗法的一种极具潜力的候选靶点。
晚期癌症往往会积累大量的DNA突变,从而就会使得癌症更具侵袭性且更好地抵御药物;其中很多突变都是由能加速肿瘤进化的APOBEC来引发的,因此,杀灭能激活APOBEC系统的癌细胞或许就能减缓肿瘤的进化并防止其获得新型危险性的突变。综上,研究人员揭示,HMCES的破坏和A3A的表达均会增加癌细胞对电离辐射、氧化性压力和ATR抑制的敏感性,这些策略均是在肿瘤治疗过程中经常使用的方法;因此HMCES或能作为开发A3A表达肿瘤的选择性疗法的一种非常有吸引力的靶点。
【7】Cell:重大进展!中美科学家成功在体外利用构建出人-猴嵌合胚胎
doi:10.1016/j.cell.2021.03.020
在一种物种的有机体内生长另一种物种的细胞的能力为科学家们提供了一个强大的用于研究和医学的工具。这种方法可以促进我们对人类早期发育、疾病发生和进展以及衰老的理解;为药物评估提供创新平台;并解决对可移植器官的关键需求。然而开发这样的工具一直是一个艰巨的挑战。在一项新的研究中,来自中国昆明理工大学和美国沙克生物学研究中心等研究机构的研究人员通过展示一种新的将人类细胞整合到动物组织中的方法,向这一目标迈进了一步。这为了解一系列疾病并解决供体器官的严重短缺问题奠定基础。相关研究结果发表在2021年4月15日的Cell期刊上,论文标题为“Chimeric contribution of human extended pluripotent stem cells to monkey embryos ex vivo”。
在这项新的研究中,这些作者用荧光蛋白标记了人EPS干细胞(能够发育成体内所有细胞类型的细胞),并将这些标记的干细胞插入到培养皿中的食蟹猴胚胎内。这项新的研究得益于他们去年发表的技术,该技术使得猴子胚胎能够在体外长时间保持活力和生长(Science, 2019, doi:10.1126/science.aaw5754)。在这项新的研究中,所有的实验都在干细胞注射19天后终止。通过让抗体与荧光标记的EPS干细胞结合,他们观察到人类干细胞的存活和整合效率比之前在猪组织中的实验相对要好。在这项新的研究中,这些作者在食蟹猴身上测试了这些EPS细胞。他们将25个人EPS干细胞分别插入132个食蟹猴胚胎中,并将所获得的嵌合体在培养皿中培养长达20天。他们发现,人类细胞显示出了持久的能力:13天后,它们仍然存在于三分之一的嵌合体中。人类细胞似乎与食蟹猴细胞融合在一起,并已开始特化为将发育成不同器官的细胞类型。
嵌合体可以提供独特见解的另一个研究途径是衰老。这些作者表示,科学家们不知道在嵌合体中,器官是否以同样的速度衰老,或者也许一种器官推动了所有其他器官的衰老,并作为衰老过程的总开关。例如,利用嵌合体在裸鼹鼠等寿命更长的物种中生长出普通大鼠的器官,这样科学家们就可能开始探究哪些器官可能是衰老的关键,以及哪些信号参与了它们的生存。下一步,这些作者计划仔细研究他们确定的参与物种间交流的分子途径,并确定哪些途径对这一过程的成功至关重要。
【8】EMBO J:去泛素化酶USP7的抑制剂或有望作为新型疗法发挥抗癌作用
doi:10.15252/embj.201899692
理解控制细胞分裂的组分对于科学家们阐明生命体的工作机制,以及这一微妙过程的改变如何导致诸如癌症等疾病的发生至关重要,而这也正是细胞周期关键调节子的发现和其对癌症等过程的影响。基于稳定p53的能力,去泛素化酶USP7的化学抑制剂目前正在被开发用作新型抗癌药物,无论其活性如何,USP7的抑制剂也会以一种不依赖p53的方式来产生DNA损伤,然而,这种基因毒性的机制及其对USP7抑制剂的抗癌效应的影响目前在科学界仍然存在一定的争议。近日,一篇发表在国际杂志The EMBO Journal 上题为“USP7 limits CDK1 activity throughout the cell cycle”的研究报告中,来自西班牙国立癌症研究中心等机构的科学家们通过研究发现了一种新型的细胞周期控制元件—USP7蛋白,其或能扮演制动器的角色来阻断细胞分裂,直到复制遗传物质的过程被完成,同时其还能监测细胞中遗传物质的复制过程来确保其处于正确发生的状态;USP7就好像是细胞中的队长一样,其能让驱动细胞分裂的引擎保持低速运转的水平。
USP7抑制剂作为抗癌药物的开发主要基于其能激活肿瘤抑制蛋白P53的活性,P53是一种有效的细胞自杀诱导子;然而在2016年发表的这篇研究报告中,研究人员发现,这些抑制剂对基因组复制的影响并不完全与P53有关,本文研究数据则表明,USP7对于携带或不携带p53的细胞的基因组复制都是必不可少的。那么,如果不通过P53的话,这些抑制剂又是如何促进肿瘤细胞死亡的呢?这篇研究报告中,研究人员就发现,这些抑制剂/药物对调节细胞分类的细胞周期“机器”会产生直接效应;尤其是,利用这些抑制剂的疗法或能诱发CDK1蛋白质的过早和广泛激活,而CDK1是细胞周期的关键驱动子,其会导致细胞分裂失控、DNA损伤乃至最终的细胞死亡。
实际上,通过解除对CDK1的调节来发挥作用的USP7抑制剂或能为科学家们开发新型组合性抗癌疗法以及增加药物的有效性提供新的思路和线索。研究者指出,目前有几种抗癌疗法正在进行临床试验,其作用水平相同,即有利于促进CDK1过早激活,比如ATR或WEE1抑制剂等。研究者表示,USP7抑制剂与其它能促进CDK1活性的抑制剂的组合性疗法所产生的效应或许是协同性的,而且还会增加这些化合物在癌症患者机体中的抗癌效应;此外,研究人员还推测,能降低CDK1活性的药物或回降低USP7抑制剂的疗效。
本文研究结果对于这些USP7抑制性化合物的使用也具有重要的意义,因为其证实了2016年研究人员的观察性研究结果,即这些药物能有效发挥作用而与肿瘤是否表达P53无关;最初研究人员的想法是,通过刺激P53来发挥作用的USP7抑制剂或能限制其在肿瘤中表达该蛋白的患者的应用潜力,这种情况出现的比例略低于50%。因此,这些抑制剂或会通过一种P53非依赖性的机制来发挥作用,同时这一研究发现也为更多患者的治疗提供了新的线索和应用前景。
综上,本文研究中研究人员揭示了USP7或能在所有细胞周期阶段限制CKD1的活性,这或许就提供了一种新型机制,通过过早激活CDK1来帮助解释USP7抑制剂的毒性效应。目前研究人员正在重点阐明癌细胞对诸如USP7抑制剂等抗癌疗法产生耐受性的新型分子机制,从而有望改善新型疗法在临床治疗中的应用和治疗效率。
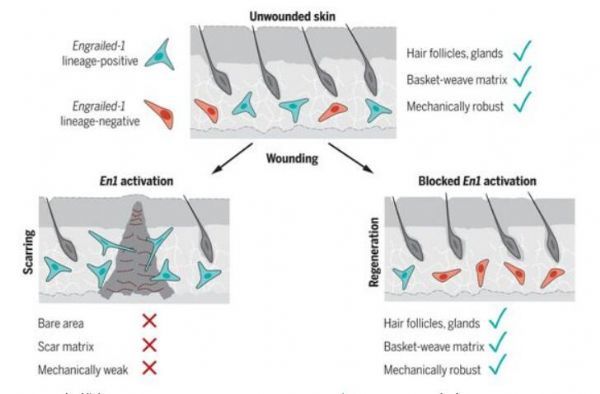
皮肤成纤维细胞中的Engrailed-1激活导致疤痕形成。
图片来源:Science, 2021, doi:10.1126/science.aba2374
【9】Science:阻止成纤维细胞的Engrailed-1基因激活可使皮肤伤口愈合而不留下疤痕
doi:10.1126/science.aba2374
在一项新的研究中,来自美国斯坦福大学医学院的研究人员想要了解疤痕成纤维细胞(scarring fibroblast, ,也称为瘢痕成纤维细胞)是否纯粹来自于未受伤皮肤中现有的En1阳性成纤维细胞的扩增,或者En1阳性疤痕成纤维细胞是否可以通过激活出生后的En1阴性成纤维细胞在伤口微环境(wound niche)中的En1表达而从新产生。相关研究结果发表在2021年4月23日的Science期刊上,论文标题为“Preventing Engrailed-1 activation in fibroblasts yields wound regeneration without scarring”。
这些作者使用成纤维细胞移植以及转基因小鼠模型来追踪En1在空间时间上的表达。他们研究了成纤维细胞对体外和体内机械力的反应,以建立一种将皮肤张力与出生后的En1表达联系起来的机械传导机制。接着,他们用化学方法(通过使用维替泊芬)和转基因方法[利用白喉毒素剔除表达En1的成纤维细胞,通过将编码YAP的DNA序列放入两个loxP位点之间实现YAP基因敲除]抑制机械传导信号来调节伤口愈合期间的En1表达。他们通过RNA测序、定量组织病理学比较(使用自定义图像处理算法)和机械强度测试,将实验性伤口与未受伤的皮肤和疤痕(使用磷酸盐缓冲盐水作为对照)进行比较。
综上所述,通过揭示物理刺激如何引起ENF细胞促进皮肤纤维化,这些作者确定了YAP和En1是预防疤痕的潜在分子靶点。此外,他们发现,抑制YAP信号可以防止En1在伤口愈合过程中的激活,从而促进ENF细胞介导的伤口修复而不发生皮肤纤维化,在此过程中还会再生毛囊和皮脂腺。这些研究结果表明,如果可以阻断机械驱动的皮肤纤维化倾向,出生后哺乳动物皮肤中残留的ENF细胞仍有能力实现皮肤再生。他们证实出生后哺乳动物的皮肤伤口可完全实现再生性愈合,而不会留下疤痕。这一发现对每年数以千万计出现疤痕和其他纤维化的患者具有临床转化方面的意义。
【10】Mol Psych:摄入Ω-3补充剂或能有效减缓机体衰老的影响效应及患抑郁症的风险
doi:10.1038/s41380-021-01077-2
高水平的Ω-3往往与较长的端粒、较低水平的炎症、交感神经和心血管应激反应迟钝直接相关;那么补充Ω-3是否会改变端粒酶、皮质醇的压力反应以及机体的炎症水平呢?目前研究人员并不清楚;近日,一篇发表在国际杂志Molecular Psychiatry上题为“Omega-3 supplementation and stress reactivity of cellular aging biomarkers: an ancillary substudy of a randomized, controlled trial in midlife adults”的研究报告中,来自俄亥俄州立大学等机构的科学家们通过研究发现,每天摄入高剂量的Ω-3补充剂或能在分子水平上通过抑制压力事件期间或压力事件后的炎症水平并增强保护效应来减缓机体衰老所产生的影响。
研究者发现,日常摄入含有2.5克Ω-3多不饱和脂肪酸(测试的最高剂量)的补充剂在帮助机体抵御压力所产生的破坏性效应上或能产生最佳的效果。与安慰剂组相比,摄入Ω-3补充剂的参与者在实验室压力事件期间往往会产生较低水平的压力激素皮质醇和促炎性蛋白;尽管安慰剂组参与者机体的保护性化合物水平在压力反应后会急剧下降,但研究人员并未在服用Ω-3补充剂的参与者机体中观察到这种下降现象。这些补充剂有助于恢复研究人员所说的压力复原力(stress resilience),即在压力期间减少损伤;在急性压力反应后能维持机体的抗炎性活性并保护因衰老而发生萎缩的细胞组分。Ω-3补充剂所产生的潜在的抗衰老效应往往非常引人注目,因为其发生在健康但却久坐、过重和中年人群机体中,所有这些特征都会导致机体衰老速度加快的风险。
通过降低压力相关的炎症水平,Ω-3或能帮助干扰反复压力和抑郁症症状之间的关联,此前研究结果表明,在实验室中对压力产生较高炎性反应的个体或许会随着时间推移出现更多的抑郁症症状;并非每个抑郁症患者都会出现炎症水平加重的表现,大约有三分之一人群有这种表现;这就能帮助解释为何Ω-3补充剂并不总是会减少机体的抑郁症症状了;如果机体炎症水平没有家中,那么Ω-3或许并不会非常有效,但对于患抑郁症的人群而言,Ω-3就能发挥一定的作用。
综上,本文研究表明,通过降低压力期间机体总体的炎症和皮质醇水平,同时增强恢复过程中机体的修复机制,Ω-3或能有效减缓机体的衰老影响效应以及个体患抑郁症的风险;此外,研究者指出,2.5克的Ω-3要比大多数美国人日常所摄入的剂量要高,但参与者并未表现出摄入补充剂出现问题的迹象。(生物谷Bioon.com)
更多精彩阅读:
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。