Chemical Science:smFRET检测GPCR调控下游蛋白arrestin的构象分布研究中获进展
来源:生物物理所 2021-07-13 12:26
G蛋白偶联受体(GPCR)是目前已知的人类基因组中最大的膜蛋白家族,约30%的临床处方药的直接靶点是GPCR,负责80%左右的跨膜信号转导,参与调控人体中多数病理与生理过程。GPCR主要通过G蛋白及arrestin将细胞外的刺激转变为细胞内信号。近年来,结构生物学研究方法的进步为研究GPCR及其下游蛋白arrestin和G蛋白的功能奠
G蛋白偶联受体(GPCR)是目前已知的人类基因组中最大的膜蛋白家族,约30%的临床处方药的直接靶点是GPCR,负责80%左右的跨膜信号转导,参与调控人体中多数病理与生理过程。GPCR主要通过G蛋白及arrestin将细胞外的刺激转变为细胞内信号。近年来,结构生物学研究方法的进步为研究GPCR及其下游蛋白arrestin和G蛋白的功能奠定了良好的基础。目前,研究GPCR及下游蛋白结构的常用方法主要有晶体学、NMR、冷冻电镜。然而,通过晶体或电镜结构获得的信息,对于GPCR结构和功能的理解往往只能从静态水平出发,较难捕获GPCR构象动态转换的动力学过程以及与下游蛋白相互作用时的瞬时调节过程。NMR 光谱可捕获GPCR及其下游蛋白的动态过程,却不能检测其构象状态分布。
前期工作中,山东大学教授孙金鹏与中国科学院生物物理研究所教授王江云研究团队,针对受体与arrestin相互作用的磷酸化编码机制展开了研究工作,发现了GPCR磷酸化编码机制,提出了受体磷酸化的“笛子模型”理论【Nature Communications 6, 8202 (2015)】。基于“笛子模型”的理论基础,该合作团队进一步揭示了GPCR磷酸化编码别构调控SH3 domain蛋白的多聚脯氨酸码头分选机制【Nature Chemical Biology 14, 876-886 (2018)】。近日,该合作团队结合晶体学、DeSiPher和BRET等技术手段,检测了GPCR单个磷酸化位点缺陷可引起arrestin远端功能结构域产生不同的构象变化,并发现了其与arrestin生物学功能的相关性【Nature Communications 12, 2396 (2021)】。
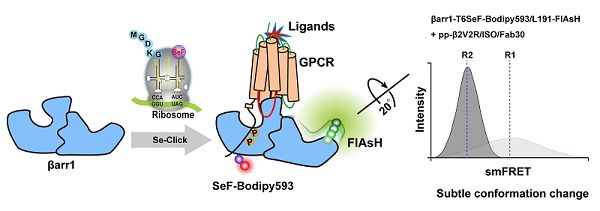
为捕获GPCR调控下游蛋白arrestin的构象状态分布,王江云团队、孙金鹏团队,以及清华大学教授陈春来团队合作,在Chemical Science上在线发表了研究论文Single-molecule FRET and conformational analysis of β-arrestin-1 through genetic code expansion and Se-Click reaction。科研团队利用基因密码扩展技术选择特异性的将非天然氨基酸SeF插入到arrestin的特定位点,然后将荧光染料Bodipy593特异性标记到SeF,从而实现将Bodipy593在arrestin上的定点标记作为受体,同时,研究团队在arrestin的特异位点插入了CCPGCC用以标记FlAsH-EDT2来作为供体,借助清华大学TRIF荧光显微镜平台,通过点击反应进行单分子FRET检测磷酸化GPCR调控arrestin的不同构象状态分布。
该方法创新性地利用基因密码子扩展技术将非天然氨基酸SeF整合到arrestin的特定位点,通过取代反应实现了高效率、特异性标记Bodipy593,标记后的SeF-Bodipy593相比较Bodipy593出现了47 nm的红移,更能降低信号的背景噪音。相比传统的Cy3-Cy5标记方法,避免了arrestin蛋白中的所有Cysteine突变,SeF-Bodipy593和FlAsH以更短的linker实现了染料对蛋白的特异性标记,更易精准的检测出arrestin在激活前后微小的构象变化及其状态分布。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


