Cell Metab | 中山大学郑健/王力勤/林东昕发现QDPR缺陷驱动胰腺癌的免疫抑制
来源:生物探索 2024-04-24 09:21
该研究证明了肿瘤细胞劫持生物蝶呤代谢与肿瘤免疫之间的相互作用提出QDPR作为ICB的生物标志物,补充BH4可以克服QDPR缺乏症PDAC的ICB抗性。
中山大学郑健、王力勤及林东昕共同通讯在Cell Metabolism在线发表题为“QDPR deficiency drives immune suppression in pancreatic cancer”的研究论文,该研究发现,在胰腺导管腺癌(PDACs)中,调节生物蝶呤代谢的关键酶—醌类二氢蝶呤还原酶(QDPR)的缺乏会导致代谢物二氢生物蝶呤(BH2)的积累,并降低四氢生物蝶呤(BH4)与BH2的比值。
BH4/BH2比值降低导致活性氧(ROS)生成增加,H3K27me3在CXCL1启动子处的分布减少。因此,髓源性抑制细胞通过CXCR2被募集到肿瘤微环境中,导致对ICB治疗产生耐药性。研究发现补充BH4能够恢复BH4/BH2比例,增强抗肿瘤免疫,并克服QDPR缺陷PDACs的ICB抗性。QDPR表达较低的肿瘤对ICB治疗的反应性降低。这些发现为选择患者和联合治疗提供了一种新的策略,以提高ICB治疗PDAC的有效性。

胰腺导管腺癌(PDAC)以高度免疫抑制肿瘤微环境(TME)为特征,对免疫检查点阻断(ICB)治疗(如抗PD-1和抗CTLA-4治疗)具有耐药性。髓源性抑制细胞(Myeloid-derived suppressor cells, MDSCs)在诱导免疫抑制和包括PDAC在内的癌症中ICB耐药中发挥关键作用。揭示免疫抑制机制将为提高ICB的治疗效果提供一种新的策略。代谢重编程是癌症的一个标志,它赋予肿瘤细胞重塑TME进入免疫抑制状态的能力。
生物蝶呤代谢涉及代谢物的合成和转化,主要包括七蝶呤、四氢生物蝶呤(BH4)、醌类二氢生物蝶呤(qBH2)和二氢生物蝶呤(BH2)核心代谢物BH4是几种酶的辅助因子,如芳香氨基酸羟化酶和一氧化氮合酶(NOS)。BH4/BH2比值的降低导致NOS从产生NO向活性氧(ROS)的功能转变。最近,生物蝶呤代谢被报道与肿瘤发生有关。此外,已证实T细胞中的代谢产物BH4和sepapterin可促进T细胞增殖,提示生物蝶呤代谢在肿瘤免疫中起关键作用。然而,肿瘤细胞内的生物蝶呤代谢能否被劫持,从而重塑肿瘤免疫微环境,目前尚不清楚。
在生物蝶素代谢途径中,醌类二氢蝶啶还原酶(quoid dihydropteridine reductase, QDPR)主要催化qBH2转化为BH4。现有文献表明,QDPR可以抵消肿瘤细胞中四氢叶酸的氧化,同时保持细胞内叶酸浓度。然而,QDPR在肿瘤中的表达模式、对肿瘤预后的影响、与肿瘤免疫原性的相关性以及对BH4/BH2比值的影响尚不清楚。
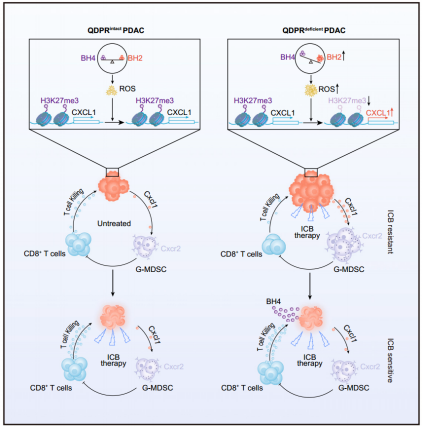
模式图(Credit: Cell Metabolism)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


