Nat Cell Biol:科学家解析MAF蛋白促进乳腺癌转移背后的分子机制
来源:生物谷原创 2023-11-23 15:30
来自巴塞罗那科技学院等机构的科学家们通过研究揭示了MAF蛋白增加乳腺癌患者发生转移风险背后的分子机制,这一研究发现或许是理解乳腺癌转移分子基础的关键一步,对于疗法的开发具有相关的临床意义。
乳腺癌是女性中最常见的癌症类型,每年有超过200万新发乳腺癌病例,在肿瘤仍然仅局限在乳腺组织的情况下,患者的存活率非常高,大约为90%左右;然而,当癌细胞扩散到乳腺组织之外并开始在其它器官中形成转移的时候,就会显著恶化患者的预后并给其治疗带来极大挑战。此前的研究中,研究人员认为MAF蛋白或与乳腺癌转移风险增加直接相关,但其二者之间关联背后的原因,研究人员并不清楚。
近日,一篇发表在国际杂志Nature Cell Biology上题为“MAF amplification licenses ER through epigenetic remodeling to drive breast cancer metastasis”的研究报告中,来自巴塞罗那科技学院等机构的科学家们通过研究揭示了MAF蛋白增加乳腺癌患者发生转移风险背后的分子机制,这一研究发现或许是理解乳腺癌转移分子基础的关键一步,对于疗法的开发具有相关的临床意义。
这项研究中,研究人员详细揭示了MAF蛋白如何与雌激素受体相互作用从而改变其结构,雌激素受体是乳腺癌发生的关键要素,这种相互作用或许会导致DNA重组,从而允许促进癌症转移的基因被激活,尤其是对雌激素产生反应,这些研究结果表明,携带高水平MAF蛋白的患者或许发生乳腺癌转移的风险会更大。文章中,研究人员揭示了通过抑制KDM1A(负责DNA重组)分子来阻碍前转移激活从而预防乳腺癌转移的可能性,这或许就为开发新型乳腺癌疗法提供了新的视角,这项研究是在培养中的细胞和疾病动物模型中进行的,同时也在患者样本中得到了验证。此前研究人员通过研究证实了增加MAF蛋白水平与用于预防乳腺癌转移到骨质的“双磷酸盐”(bisphosphonate)疗法耐受性之间的关联。
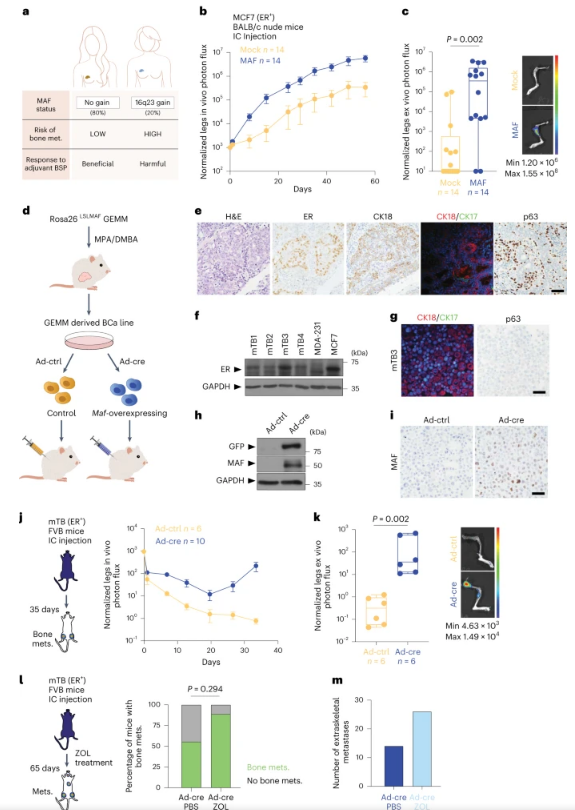
科学家解析MAF蛋白促进乳腺癌转移背后的分子机制。
图片来源:Nature Cell Biology (2023). DOI:10.1038/s41556-023-01281-y
因此,检测高水平的MAF或能帮助预测癌症转移的风险,并能帮助区分接受双磷酸盐疗法获益的乳腺癌患者和不适合这种疗法的乳腺癌患者,这一信息对于年轻患者而言尤为重要,在某些情况下,能针对骨骼转移部位的疗法或许会促使癌症转移到其它器官中,这对于缓和总体的生存或许会产生一定的负面影响。研究者Gomis博士表示,这一研究发现或许是理解人类乳腺癌扩散的关键一步,也为20%无法从双磷酸盐疗法中获益的患者提供新的治疗机会。
MAF的检测或能帮助识别癌症转移风险较高的乳腺癌患者,也有助于肿瘤学家对每个病例做出最合适的治疗选择。目前研究人员已经确定了一种元件抑制剂—KDM1A蛋白,同时其也是乳腺癌转移过程的关键,他们正在临床试验中对其测试来验证其疗效和安全性,这种抑制剂和相关试验独立于这篇研究报告,然而,如果这种潜在的药物被证实是有效的,研究人员或许就能通过帮助预防转移的发展来为机体MAF水平较高的患者提供一定的治疗效益。
综上,本文研究揭示了MAF/雌激素所介导的乳腺癌转移的分子基础,其或许需要来自机体全身环境的遗传、表观遗传和激素信号,而这些信号则会影响乳腺癌细胞发生转移的能力。(生物谷Bioon.com)
原始出处:
Llorente, A., Blasco, M.T., Espuny, I. et al. MAF amplification licenses ERα through epigenetic remodelling to drive breast cancer metastasis. Nat Cell Biol (2023). doi:10.1038/s41556-023-01281-y
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


