《科学·免疫学》:抑制抗癌免疫的调节性T细胞,竟然后继有“人”!
来源:网络 2023-12-20 09:19
在这部分免疫抑制性常规T细胞身上,研究者们发现了CTLA-4、ICOS等典型的免疫检查点及TIGIT、TIM-3等共抑制分子,用来识别此类细胞的最佳表面标志物则是趋化因子受体CCR8
近日,剑桥大学研究团队在《科学·免疫学》(Science Immunology)上发表的最新研究成果就揭示,肿瘤微环境中不利于免疫治疗起效的调节性T细胞(Treg),竟然也存在“前赴后继”的现象:在定向清除掉原有调节性T细胞后,肿瘤内的特定常规T细胞(TConv,特征为表达CCR8)会主动“继承”调节性T细胞的免疫抑制功能,继续束缚CD8+T细胞。
要想破解这“第二层”免疫抑制,就需要通过抑制白介素-10(IL-10),压制CCR8+常规T细胞的活性,来为抗肿瘤免疫进一步松绑,这不仅能解释既往靶向调节性T细胞的疗法为何收效不佳,还对免疫抑制及其调控机制的研究颇有启示意义。

论文首页截图
调节性T细胞在抗肿瘤免疫中举足轻重的作用,相信各位读者都耳熟能详,所以它被科学家和医生们盯上可不是一两天了,既往开发的疗法大多都是以单克隆抗体,靶向调节性T细胞表面高表达的CD25、CCR4等靶点,但单抗们大多在早期临床研究中就败北了[2-3]。
就算是失败,也得把失败背后的原因搞明白,这样的探索才有意义。为评估清除调节性T细胞后肿瘤免疫微环境的变化,剑桥团队使用了专门的条件性敲除小鼠模型(Foxp3EGFP-DTR),将黑色素瘤细胞植入小鼠体内后再清除调节性T细胞:如在肿瘤体积未明显增大时即进行清除,则有一定的抗肿瘤作用,但肿瘤已充分生长后再清除就基本无效了。
而对肿瘤内CD4+/CD8+T细胞进行的转录组学分析显示,清除调节性T细胞后,一大批正常情况下会在调节性T细胞中表达富集的基因,却会在肿瘤内原有的CD4+/CD8+常规T细胞中表达开始上调;研究者们单独把其中的CD4+常规T细胞纯化提取出来,发现它们已具备了与转录组学改变相应的免疫抑制功能,而且抑制性只比原有的调节性T细胞略逊一筹。
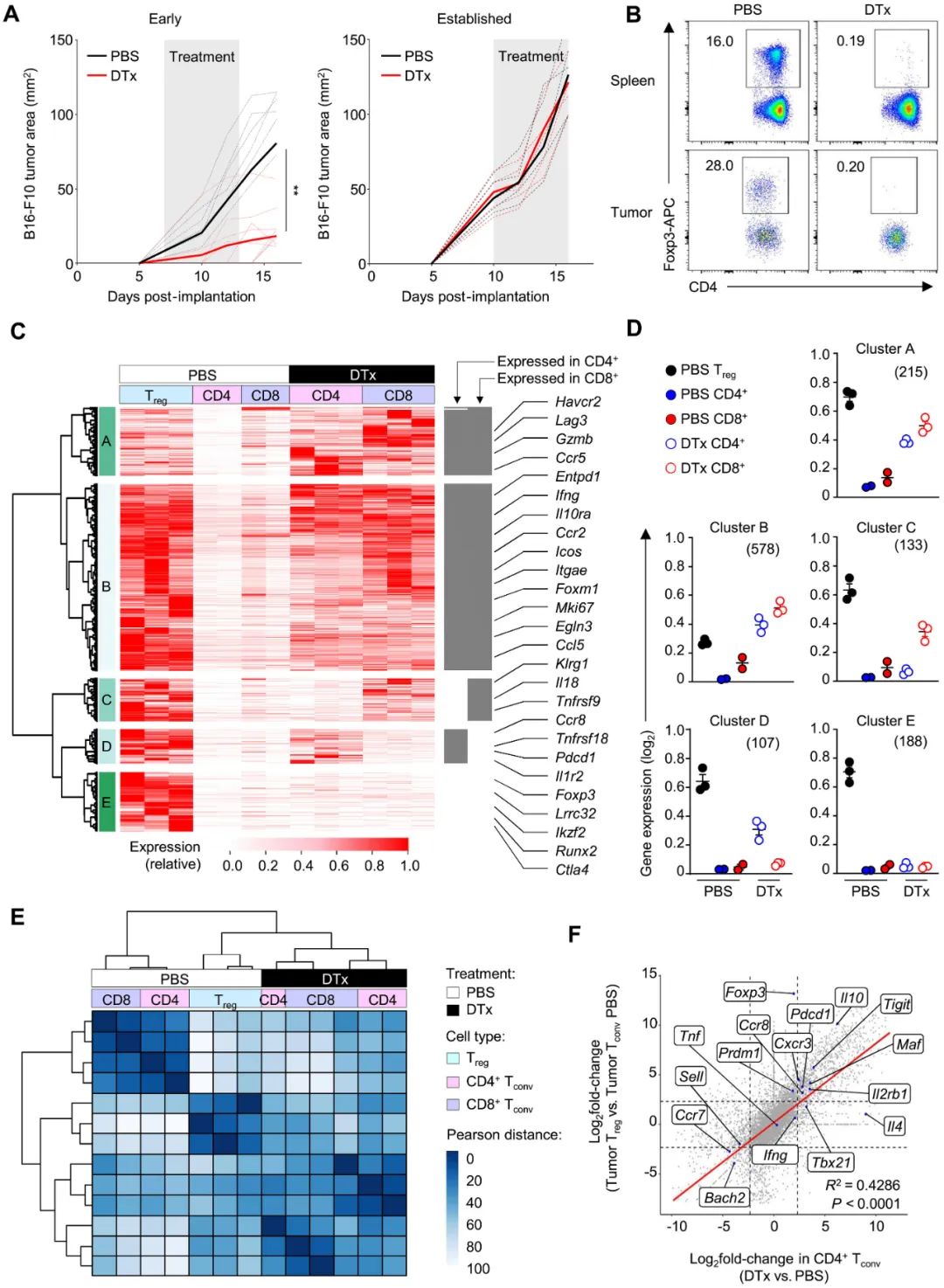
清除调节性T细胞后,一部分常规T细胞就会继承相似的转录组学特征
在这部分免疫抑制性常规T细胞身上,研究者们发现了CTLA-4、ICOS等典型的免疫检查点及TIGIT、TIM-3等共抑制分子,用来识别此类细胞的最佳表面标志物则是趋化因子受体CCR8;清除调节性T细胞后,CCR8+常规T细胞在脾脏的数量增多相对最明显,而在肿瘤内的CCR8+常规T细胞则呈高度激活状态,也就是说它们的免疫抑制性极强。
接下来,剑桥团队分析了48例非小细胞肺癌(NSCLC)患者的组织样本和血样,证实在人类癌症患者中也存在CCR8+免疫抑制性常规T细胞,它们的表面标志物和免疫抑制分子表达与小鼠实验中基本相符,且其频率与瘤内浸润的CD8+细胞毒性T细胞负相关,可以说势不两立;清除调节性T细胞后,这些CCR8+免疫抑制性常规T细胞数量也会扩增。
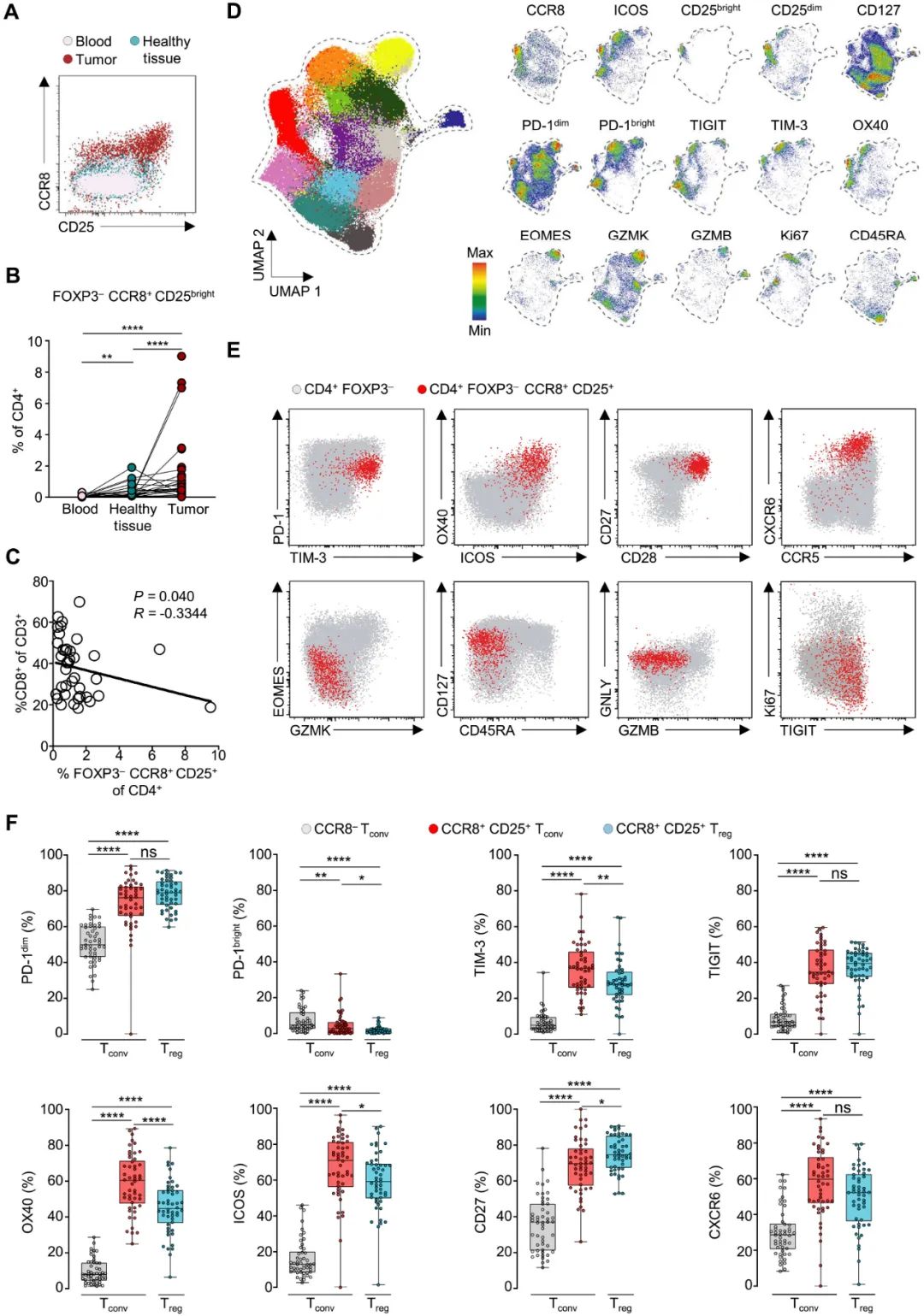
肺癌患者中存在CCR8+免疫抑制性常规T细胞
那么CCR8+免疫抑制性常规T细胞最主要的免疫抑制手段是什么呢?研究团队尝试用各种抑制性单抗进行处理,发现抗IL-10受体(IL-10R)单抗处理的效果最明显,且在清除调节性T细胞后,CCR8+免疫抑制性常规T细胞内的IL-10 mRNA水平确实显著上调,进一步阻断IL-10信号就可打压住CCR8+免疫抑制性常规T细胞,重新有效抑制肿瘤增长。
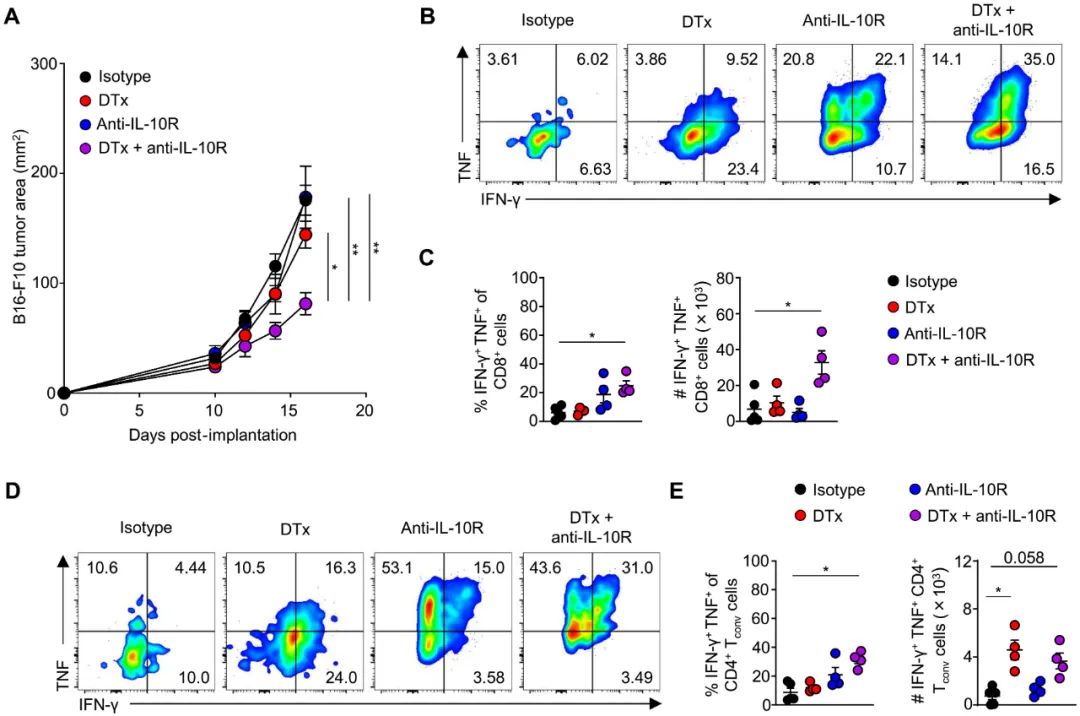
阻断IL-10信号可与清除调节性T细胞协同增效,再度呈现抑癌效果
从某种程度上来说,本次研究找到的CCR8+免疫抑制性常规T细胞,算是代偿性顶上了调节性T细胞的免疫抑制功能,但研究也只分析了清除调节性T细胞时的状态,在使用免疫检查点抑制剂时,这类细胞会不会发挥同样的作用?如果不会的话,有没有类似的“第二层免疫抑制”机制,关键的细胞亚群又是什么?这些问题就有待未来的科研工作揭晓啦。
参考文献:
[1]Whiteside S K, Grant F M, Alvisi G, et al. Acquisition of suppressive function by conventional T cells limits antitumor immunity upon Treg depletion[J]. Science Immunology, 2023, 8(90): eabo5558.
[2]Jacobs J F M, Punt C J A, Lesterhuis W J, et al. Dendritic cell vaccination in combination with anti-CD25 monoclonal antibody treatment: a phase I/II study in metastatic melanoma patients[J]. Clinical Cancer Research, 2010, 16(20): 5067-5078.
[3]Zamarin D, Hamid O, Nayak-Kapoor A, et al. Mogamulizumab in combination with durvalumab or tremelimumab in patients with advanced solid tumors: a phase I study[J]. Clinical Cancer Research, 2020, 26(17): 4531-4541.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


