近期科学家们在CNS杂志上发表的类器官研究领域新成果!
来源:生物谷原创 2022-09-28 22:27
本文中,小编整理了科学家们近期在CNS杂志上发表的有关类器官研究领域取得的重要研究成果,分享给大家!
本文中,小编整理了科学家们近期在CNS杂志上发表的有关类器官研究领域取得的重要研究成果,分享给大家!
【1】Cell Stem Cell:新研究优化人类小肠类器官的产生
doi:10.1016/j.stem.2022.08.002
在一项新的研究中,来自荷兰皇家艺术与科学学院和玛西玛公主儿科肿瘤中心的研究人员改进了人类小肠类器官(small intestinal organoids)---小肠的微型版本---的培育。这将帮助人们更好地研究小肠在健康和疾病期间的功能。具体来说,他们成功地开发出了包含成熟的潘氏细胞(Paneth cell)的小肠类器官,而潘氏细胞在以前的人类小肠类器官中是不存在的。相关研究结果于2022年8月23日在线发表在Cell Stem Cell期刊上。
类器官的培育对于人类器官和组织的功能研究意味着很多。这与这些微型器官能很好地代表人类生物学这一事实有关。然而,目前可用的一些人类类器官,如小肠类器官,还不能完全类似于天然的小肠器官。因此,这些作者开发出一种新的、优化版本的微型小肠:包括人类小肠所有细胞类型的类器官。小肠含有各种各样的细胞,如肠上皮细胞(enterocyte)、干细胞和潘氏细胞。这些细胞共同构成了食物通过的一侧与血管和免疫细胞所在的一侧之间的屏障。小肠中的干细胞不断产生所有成熟的细胞类型,从而保持屏障的良好状态。特别是,潘氏细胞对于预防感染非常重要。它们通过产生对抗有害细菌的抗菌肽来做到这一点。
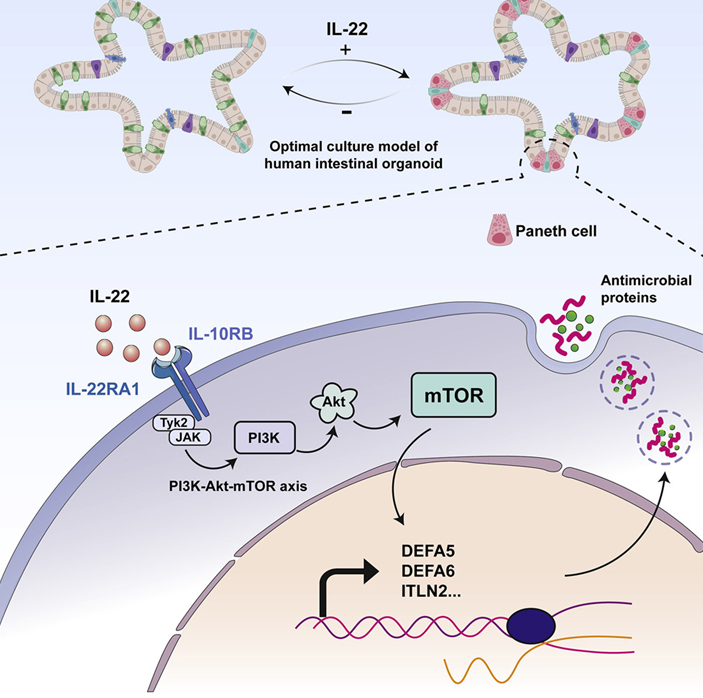
图片来源:Cell Stem Cell, 2022, doi:10.1016/j.stem.2022.08.002。
如果缺乏活跃的潘氏细胞,小肠将更容易受到感染。这是包括炎症性肠病(IBD)在内的几种疾病中的一个问题。以前的类器官缺乏潘氏细胞,因此不能完全代表健康的人类小肠,而Toshi Sato于2009年在Nature期刊上描述的原始小鼠类器官是完整的(Nature, 2009, doi:10.1038/nature07935)。这表明人类类器官模型还有改进的余地。为了诱导人类小肠类器官中潘氏细胞的形成,这些作者研究了多种分子的影响。他们发现,白细胞介素-22(IL-22)增加了潘氏细胞的数量和活性。IL-22对潘氏细胞的影响是令人惊讶的。论文共同第一作者、荷兰皇家艺术与科学学院研究员Gui-Wei He解释了其中的原因:“目前,人们认为IL-22能促进干细胞功能。我们的研究实际上表明,IL-22并没有这样做,而是刺激了潘氏细胞的激活。”因此,这种新发现的IL-22功能被用来增加人类小肠类器官中活跃的潘氏细胞的数量。这导致了模拟健康小肠的类器官的构建。
【2】Nature:科学家利用人类多能干细胞生成3D泪腺类器官!
doi:10.1038/s41586-022-04613-4
泪腺是眼睛的主要外分泌腺体。它们位于眼眶内,上眼睑后面,朝向每只眼睛的颞叶侧,分泌泪液作为泪膜的主要成分。泪腺对建立和维持健康的泪膜、保持良好的视力有重要作用。泪腺功能障碍和泪液分泌减少与一系列病因有关,并且是最常见的自身免疫性疾病之一——斯约克伦综合症的特征,在这种情况下会导致干眼症。胎儿哺乳动物的泪腺细胞具有再生能力。然而,在成人中,泪腺的再生能力似乎很小。因此,科学家们将泪腺确定为旨在使用人多能干(PS)细胞进行再生治疗和药物发现的研究靶标。
近日,来自日本大阪大学的研究学者在Nature上发表了一篇题为“Generation of 3D lacrimal gland organoids from human pluripotent stem cells”的研究论文,他们从人类多能干细胞生成了3D泪腺类器官。在本研究中,他们鉴定了具有泪腺原基特征的细胞,这些细胞出现在从人类多能干细胞培养的二维眼样类器官中。含有眼表上皮样细胞的SEAM区3会产生泪腺的前体。他们采用流式细胞仪对从分离的泪腺样簇中获得的细胞进行分析,使用先前确定的抗体组合(抗ITGB4、抗SSEA-4和抗CD200)来识别眼表上皮干细胞。研究发现,泪腺样细胞簇被纳入SEAM内的眼表上皮干细胞群中,细胞群(CD200+?ITGB4SSEA-4)被鉴定为由hiPS细胞制造的泪腺样类器官的起源。
研究人员筛选了泪腺样类器官形成的最佳培养基,即EGF/Y-27632培养基,并在此培养基上形成了泪腺样组织类器官。当通过细胞分选分离并在规定的条件下生长时,这些细胞形成了一个三维的泪腺样组织器官,具有导管和尖头,通过出芽和分支得以实现。克隆集落分析表明,该类器官起源于多潜能的眼表上皮干细胞。器官体在形态、免疫标记特征和基因表达模式方面与本地泪腺有明显的相似性,当移植到受体大鼠的眼睛附近时,会发生功能成熟,形成管腔并产生泪膜蛋白。
doi:10.1126/science.aaw9021
干细胞衍生的类器官是体外组织和器官的模拟物,其能作为研究人类器官发育和疾病发生的重要模型,同时也能作为药物发现和诊断的平台,对于设计新型细胞和基因疗法也至关重要;然而,目前研究人员并不清楚类器官发育背后的干细胞自组装过程是如何被控制的,从而就会导致现有的类器官培养物普遍缺乏可重复性,比如小鼠肠道类器官(其或许是迄今为止被最好描述地类器官系统)中隐窝样结构的位置和数量是无法进行控制的,而且类器官的形状、大小和多细胞组成也是无法控制的,目前类器官模型的较高变异性给基于类器官的基础和转化研究带来了重大的挑战。
近日,一篇发表在国际杂志Science上题为“Tissue geometry drives deterministic organoid patterning”的研究报告中,来自瑞士的科学家们通过研究发现,形状或许会引导类器官的生长;研究者表示,对类器官形成和所产生结构进行控制既能帮助理解潜在的形态发生机制,还能帮助建立与“本地对应物”更为相似的模型。真实器官的最终功能结构是上皮细胞自组装程序和外在微环境控制器之间相互作用的产物,从体内发育中得到启发,研究人员利用外部调节机制来补充类器官的自组装,尤其是,研究人员能尝试通过物理特性来控制肠道类器官的模式和形态发生,尤其是组织自身的初始几何形状。
文章中,研究人员开发了生物工程性策略,通过水凝胶力学的原位模式和水凝胶微加工模式,从外部来控制肠道干细胞的自组装过程;他们发现,微环境力学的局部模式和预定的水凝胶微貌或能用来建立具有可控最初尺寸和形状的类器官,同时研究者还能预测并影响其发育的过程,尤其是隐窝结构的数量和未知。研究人员能利用对类器官发育的可预测性来识别出上皮细胞模式化背后的基本机制。
【4】Nat Cancer:利用功能性类器官筛选鉴定出靶向实体瘤中癌干细胞的抗体MCLA-158
doi:10.1038/s43018-022-00359-0
在一项新的研究中,由西班牙巴塞罗那生物医学研究院主任Eduard Batlle博士领导的一个国际研究小组揭示了导致MCLA-158发现的临床前数据及其对癌干细胞的作用机制。这种被命名为派森妥单抗 (Petosemtamab)的抗体MCLA-158能防止癌症转移的发生(即癌症扩散到其他重要器官),并减缓癌症实验模型中原发性肿瘤的生长。相关研究结果发表在2022年4月的Nature Cancer期刊上,论文标题为“Functional patient-derived organoid screenings identify MCLA-158 as a therapeutic EGFR × LGR5 bispecific antibody with efficacy in epithelial tumors”。在这篇论文中,他们描述了他们如何创建他们的纳米胶囊,以及当在患有胶质母细胞瘤的小鼠身上进行测试时它的效果如何。
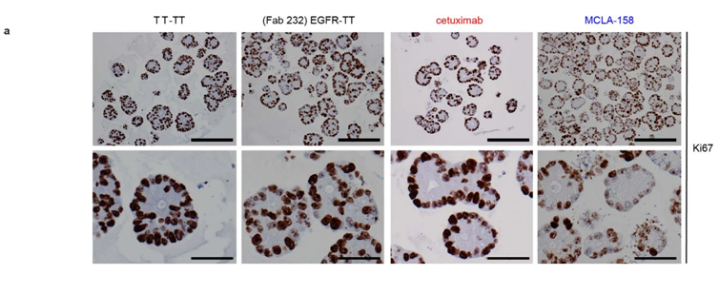
MCLA-158对患者衍生性类器官的影响。
图片来源:Nature Cancer, 2022, doi:10.1038/s43018-022-00359-0。
这项研究也为制药公司在药物发现过程中使用类器官模型奠定了基础。类器官是可以在实验室中生长的患者衍生性样本,它们再现了肿瘤区室的某些方面。到目前为止,它们的用处正在个性化癌症医学中得到探索---意思是它们在帮助医生决定每名患者的最佳治疗方面的价值。然而,为了选择MCLA-158,首次使用了来自癌症患者的类器官生物库,在数百种新抗体中分辨出哪一种最有效并最适合大多数患者。
2021年10月,荷兰Merus公司(Merus N. V.)报告了与中期疗效分析相对应的初步数据,这些数据是基于它赞助的正在进行的1期剂量扩大临床试验的回顾性分析,该临床试验旨在评估MCLA-158单药治疗晚期头颈部鳞状细胞癌(HNSCC)的安全性、耐受性和抗肿瘤活性。7名HNSCC患者中有3人获得部分反应,其中1人在2021年8月的数据截止日期后获得完全反应。所有七名患者都观察到肿瘤缩小。Batlle博士说,“看到我们的发现正在帮助患者,这是非常令人满意的。我们在15年前开始研究癌干细胞。这一路令人兴奋,但也非常复杂,它需要大量的资源投入,以及许多科学家们的大量研究工作。这项研究以及与Merus公司的合作反映了巴塞罗那生物医学研究院的关注重点:‘未来的医学从这里开始’。”
【5】Science:利用人类大脑类器官,揭示结节性硬化症的起源
doi:10.1126/science.abf5546
在一项新的研究中,在大脑类器官的帮助下,来自奥地利科学院和维也纳医科大学等研究机构的研究人员能够确定结节性硬化症(tuberous sclerosis complex, TSC)是一种罕见的神经发育遗传性疾病,它是在发育过程中产生的,而不仅仅是在遗传上。通过这些来自患者的人类大脑实验室模型,他们将这种疾病的起源确定为人类特有的尾侧晚期中间神经元祖细胞(caudal late interneuron progenitor, CLIP)。这些研究结果进一步表明,只有使用人类衍生的大脑类器官模型才能很好地理解影响人类大脑的疾病的病理。相关研究结果发表在2022年1月28日的Science期刊上。
人类大脑的复杂性很大程度上是由于发育涉及到人类独有的过程,其中许多过程仍是我们当前科学知识中的空白。TSC在这方面也不例外,因为长期以来,基于动物模型获得的数据,它被描述为一种主要的遗传性疾病。如今,论文共同通讯作者、奥地利科学院分子生物技术研究所科学主任Jürgen A. Knoblich及其研究团队的突破性研究利用患者衍生的大脑类器官模型来揭开这种罕见的神经发育疾病的神秘面纱。Knoblich解释说,“我们对TSC根源的研究结果使我们发现了一种人类大脑特有的祖细胞类型。这解释了为什么其他实验室模型不能很好地确定这种疾病的病理。”
【6】Science子刊:利用人类肾脏类器官确定化合物SCR7有望阻止肾脏损伤和治疗慢性肾脏病
doi:10.1126/scitranslmed.abj4772
在某种程度上,肾脏在受伤后有自我修复的能力,但是这种内在修复会转变为不完全修复,从而导致不可逆的损伤和慢性肾脏病(CKD)。在一项新的研究中,来自麻省总医院(MGH)研究人员利用人类干细胞衍生的肾脏类器官鉴定出对维持肾脏健康修至关重要的基因。这些发现可能会导致人们发现新的靶标,以协助预防或治疗CKD。相关研究结果发表在Science Translational Medicine期刊上。
尽管在动物研究中已经确定了参与肾脏修复的多种因子,但将这些发现转化为临床是很困难的,因为许多在动物身上被认为是安全和有效的治疗方法后来在临床试验中被发现是有毒或无效的。人类肾脏类器官,就像微型的肾脏,可能会帮助科学家们避免这些挫折。研究者Navin Gupta博士说,“我们是人类肾脏类器官研究工作的先驱,并认为它们对开发治疗慢性肾脏病的方法很有用。作为一名临床科学家,我们想在人类细胞中构建一种新的CKD模型,以促进药物开发。”
当Gupta和他的同事们将人类肾脏类器官暴露于化疗药物顺铂中时,这种治疗改变了正在进行内在修复的肾细胞中的159个基因表达和29条信号通路。他们确定的许多基因,包括两个名为FANCD2和Rad51的基因,在内在修复过程中被激活,但是当肾脏损伤变得不可逆时,它们的表达就会下降。这些基因编码的蛋白在细胞中的DNA受损时发挥着修复作用。在小鼠肾脏损伤模型和人类肾脏活组织中进行的其他实验证实了这些在肾脏类器官中发现的结果。
【7】Nature:利用大脑类器官揭示不同的自闭症风险基因对大脑发育产生相同的影响
doi:10.1038/s41586-021-04358-6
自闭症谱系障碍(ASD)与数百个不同的基因有关,但这些不同基因发生的突变如何在患者身形成相似的病理仍然是个谜。如今,在一项新的研究中,来自美国哈佛大学和布罗德研究所的研究人员发现三个不同的自闭症风险基因实际上影响着神经形成的相似方面以及发育中的人类大脑中相同类型的神经元。通过在称为“大脑类器官(brain organoid)”的人类大脑微型三维模型中测试这些基因突变,他们发现在这三个风险基因中,每个都存在类似的整体缺陷,尽管每个风险基因都通过独特的潜在分子机制发挥作用。这些结果使人们对自闭症谱系障碍有了更好的了解,并向寻找治疗这种疾病的方法迈出了第一步。相关研究结果于2022年2月2日在线发表在Nature期刊上。
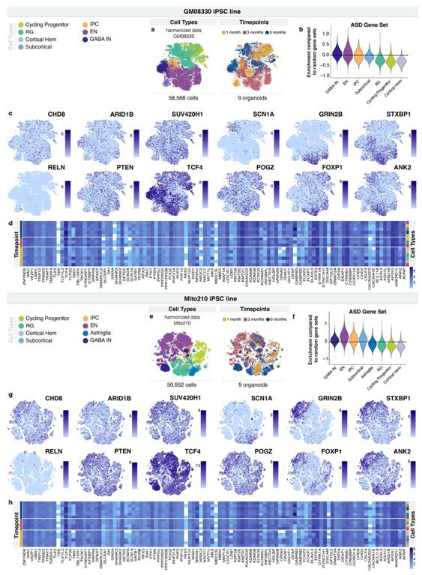
在培养1个月、3个月和6个月的皮质类器官中选定的ASD风险基因的表达。
图片来源:Nature, 2022, doi:10.1038/s41586-021-04358-6。
论文共同通讯作者、哈佛大学干细胞与再生生物学教授Paola Arlotta博士说,“该领域的许多努力都致力于了解与自闭症相关的许多风险基因之间是否存在共性。找到这样的共同特征可能会突出广泛的共同靶标用于开发治疗干预措施,而与疾病的遗传起源无关。我们的数据显示,多种致病性突变确实集中在一起影响相同的细胞和发育过程,但通过不同的机制。”
Arlotta实验室专注于人类大脑皮层的类器官模型,其中大脑皮层是大脑中负责认知、感知和语言的部分。这种模型是由干细胞长成一种三维组织而形成的,含有大脑皮层的许多细胞类型,包括能够放电和形成电路的神经元。论文共同第一作者兼论文共同通讯作者、Arlotta实验室资深博士后研究员Silvia Velasco说,“在2019年,我们公开了一种允许产生具有独特的可重复生长能力的类器官的方法。它们始终如一地以相同的顺序形成与发育中的人类大脑皮层相同类型的细胞。如今看到类器官可以用来发现像自闭症这样复杂的疾病的一些意想不到和非常新的东西,这真地是梦想成真。”
【8】Nat Commun:利用人类皮层类器官揭示小胶质细胞在阿尔茨海默病产生中的作用
doi:10.1038/s41467-022-28043-y
在科学家们寻找阿尔茨海默病的根源时,他们很难确定小胶质细胞---一种对大脑发育和成体大脑维护至关重要的免疫系统细胞---是朋友还是敌人。有证据显示,小胶质细胞的缺乏有助于淀粉样蛋白斑块的积累,其中淀粉样蛋白斑块是阿尔茨海默病的一种典型特征。另外,小胶质细胞过多也与神经元和大脑突触的破坏有关,这也是这种疾病的神经变性特征。
如今,在一项新的研究中,来自美国耶鲁大学的研究人员开发出一种方法来梳理出可能决定小胶质细胞发挥哪些作用的因素。相关研究结果近期发表在Nature Communications期刊上,论文标题为“Expression of the transcription factor PU.1 induces the generation of microglia-like cells in human cortical organoids”。研究者In-Hyun Park说道,“我们成年后拥有的所有小胶质细胞都是在我们出生前产生的。小胶质细胞在神经发生中至关重要,因为它们进行突触修剪,使神经元能够正常交流。”
在成体大脑中,它们作为一种细胞垃圾收集器发挥作用,识别并处理来自死亡神经元的碎片。但是小胶质细胞在研究时一直充满挑战,因为它们在受孕后很快形成,并迅速迁移到发育中的神经系统。一旦它们在发育中的大脑中找到了安家之所,小胶质细胞就被血脑屏障切断了与身体其他部分的大部分相互作用,其中血脑屏障保护大脑免受病原体的侵袭。小胶质细胞的功能障碍与神经发育疾病和神经退行性疾病有关,但由于人脑的模型有限,研究这种联系一直很困难。
【9】Cell Rep:肠道和肺部类器官或有望帮助开发新型先天性免疫细胞疗法
doi:10.1016/j.celrep.2022.111281
近日,一篇发表在国际杂志Cell Reports上题为“Organoids capture tissue-specific innate lymphoid cell development in mice and humans”的研究报告中,来自伦敦大学国王学院等机构的科学家们通过研究发现了一种新型创新性的方法或能在培养皿中扩大并促进先天性免疫细胞成熟;这一研究发现或有望帮助科学家们开发出新型的人类细胞疗法,从而帮助抵御多种人类慢性炎性疾病。
文章中,研究人员利用迷你肠道和肺部类器官来进行研究,结果发现,上皮细胞或能驱动组织特异性的先天性淋巴细胞(ILC,innate lymphoid cell)的发育。研究者表示,当对这些类器官进行培养时,所有的先天性淋巴细胞亚群都能成熟并呈现指数式的扩增,而且当基质被耗尽时,这一过程或许就能得到明显改善,这或许就颠覆了基于永生性机制供体细胞的金标准方法。
研究者Jowett博士说道,我们在小鼠上皮系统中的研究结果非常不错且是可重复的,但在项目早期,人类干细胞衍生的肠道类器官共培养物无法与小鼠模型的效率进行竞争,当我们开发间质细胞的剔除步骤时,我们希望非上皮部分的表现优于上皮器官,因为永生性的间质细胞是体外ILC研究的黄金标准。上皮细胞所产生的影响让研究人员大吃一惊,于是他们从对小鼠的数据中推测,上皮细胞对于组织特异性的ILC的印记非常重要,但研究人员从未提出,相比肠道间质而言,其能作为成熟的更强大的驱动力,正是这一研究发现或许就让科学家们对类器官的研究变得有趣且有意义。
【10】Nature:科学家利用类器官切片揭示神经退行性疾病早期神经病理学特征
doi:10.1038/s41593-021-00923-4
肌萎缩侧索硬化合并额颞叶痴呆(ALS/FTD)是一种致命的、目前无法治疗的神经退行性疾病,其特征是认知能力和运动功能迅速下降。阐明初始细胞病理学是治疗靶点开发的核心,但从临床症状前获得患者样本是不可行的。近日,来自英国剑桥大学的研究团队在Nature Neuroscience发表题为“Human ALS/FTD brain organoid slice cultures display distinct early astrocyte and targetable neuronal pathology”的研究成果,报告了一种由人类诱导多能干细胞(ipsC)衍生的大脑类器官切片模型。
研究人员发现,该模型再现了成熟的脑皮质结构,并显示了ALS/FTD早期分子病理学特征。通过单细胞RNA测序和生物学分析相结合,揭示了星形胶质细胞和神经元中基因转录、蛋白合成和DNA修复等各方面的功能障碍。他们还发现,星形胶质细胞的自噬信号蛋白P62表达水平升高,深层神经元中二肽重复蛋白多聚甘氨酸-丙氨酸(poly GA)积聚、DNA损伤,并经历核固缩,这个过程可以通过GSK2606414(一种蛋白激酶R样内质网激酶抑制剂)进行药理学逆转。
因此,患者特异性ipsC衍生的大脑皮质类器官切片培养是研究临床前ALS/FTD机制以及新治疗方法的一个平台。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


