肠道微生物组研究进展(第11期)
来源:生物谷原创 2022-09-30 04:24
研究表明,肠道菌群紊乱与多种疾病的发生密切相关,如消化系统疾病、内分泌系统疾病、精神系统疾病、自身免疫性疾病以及一些感染性疾病。基于此,小编针对肠道微生物组最新研究进展,进行一番梳理,以飨读者。
肠道是人体最大的消化和排毒器官,其回旋盘转的结构被形象地称为人体第二大脑。肠道中寄生着数以计亿的细菌,它们是人体内最重要的一种外环境,各种微生物按一定比例组合,相互制约,相互依存,在质和量上形成一种生态平衡。然而肠道菌群并不都是人类的朋友,按特性来讲,它们可分为3大类,即好菌、坏菌和中性菌。当人体肠道中好菌比例下降而坏菌数量上升时,人体免疫力下降,极易导致多种疾病的发生。
研究表明,肠道菌群紊乱与多种疾病的发生密切相关,如消化系统疾病、内分泌系统疾病、精神系统疾病、自身免疫性疾病以及一些感染性疾病。基于此,小编针对肠道微生物组最新研究进展,进行一番梳理,以飨读者。
doi:10.1016/j.cell.2022.08.021
在一项新的研究中,来自iMSMS(International Multiple Sclerosis Microbiome Study, 国际多发性硬化症微生物组研究)联盟的研究人员发现多发性硬化症(MS)患者和健康人的肠道细菌图谱之间存在显著差异,接受不同药物治疗的MS患者之间也存在差异。虽然这些变化中的一些以前就有报道,但大多数是首次报道。他们还发现了这些细菌可能潜在影响疾病产生和治疗反应的新机制。相关研究结果发表在2022年9月15日的Cell期刊上,论文标题为“Gut microbiome of multiple sclerosis patients and paired household healthy controls reveal associations with disease risk and course”。
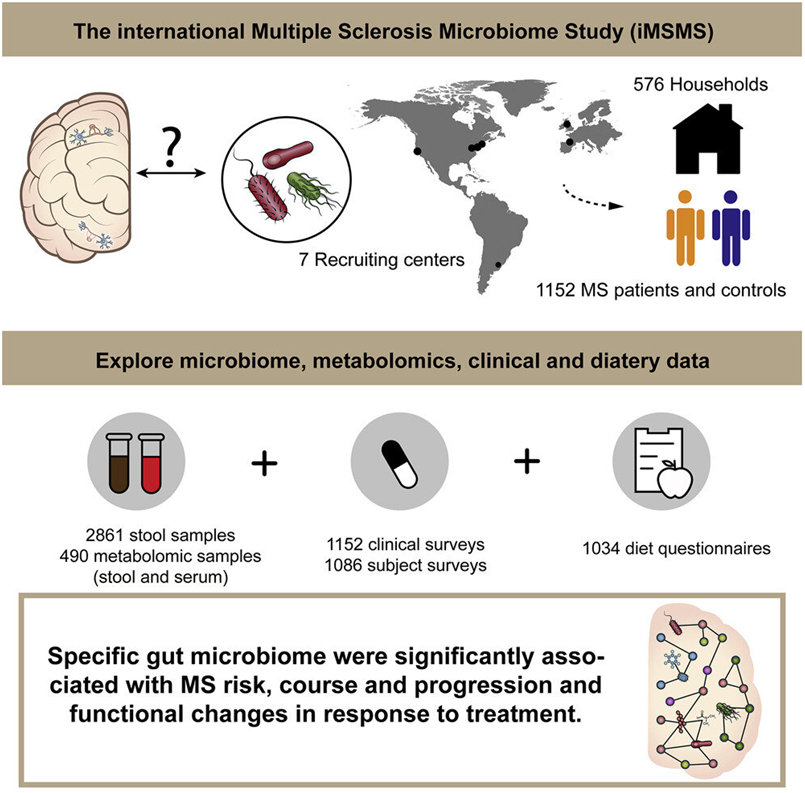
图片来自Cell, 2022, doi:10.1016/j.cell.2022.08.021。
这项新的研究描述了美国、英国、西班牙和阿根廷的576名患者和同等数量的家庭对照者之间的肠道微生物组谱差异。这些发现可能会带来新的治疗方法,涉及操纵微生物组或饮食干预。
通过他们的创新方案,Baranzini和他的同事们能够确定几十个与MS有关的新细菌物种,并确认了以前只与该疾病有关的其他物种。Baranzini说,“通过与对照者相比,我们对MS中存在不同的物种数量感到惊讶。”他们还发现,细菌物种的最大变化来源与参与者的地理位置有关,这证实了位置和当地饮食变化对肠道微生物组的重要性。第二大变异来源是参与者的疾病状况,这也是他们所预期的。
2.Science:揭示肠道微生物在人类肠道环境中与人类共同进化了数十万年
doi:10.1126/science.abm7759
人类的肠道微生物组由数千种不同的细菌和古细菌(archaea)组成,这些细菌和古细菌在不同的人群和个体之间有很大的差异。在一项新的研究中,来自德国马克斯-普朗克生物研究所的研究人员如今发现了与人类宿主有着平行进化历史的肠道微生物:这些肠道微生物在人类肠道环境中与人类共同进化了数十万年。此外,一些肠道微生物表现出的基因组特征和功能特征使得它们依赖于其宿主。这些研究结果是根据来自非洲、亚洲和欧洲的1225人的数据获得的。相关研究结果发表在2022年9月16日的Science期刊上,论文标题为“Codiversification of gut microbiota with humans”。
这些作者为1225名人类研究参与者以及在他们的肠道内发现的59种微生物创建了系统发育树,并使用统计测试来研究这些系统发育树的匹配程度。超过60%的被调查微生物物种与它们的人类宿主的进化史相匹配,这意味着当人类横跨各大洲的时候,这些微生物在人类肠道中与人类一起共同多样化了大约10万年。论文通讯作者、马克斯-普朗克生物学研究所微生物组科学系主任Ruth Ley说,“我们不知道我们的任何肠道微生物如此紧密地跟随我们的进化史。”
Ley补充说,“同样引人注目的是,最紧跟我们进化史的菌株现在是那些最依赖肠道环境的菌株。”事实上,一些与人类一起进化的微生物菌株严重依赖人类的肠道环境:它们拥有更小的基因组,对氧气水平和温度更加敏感---这些特征使得它们很难在人体外生存。相比之下,与人类进化史关联较弱的微生物表现出更多类似于自由生活细菌的特征。
3.Nature:重大进展!揭示免疫细胞ILC3在协助免疫系统对肠道益生菌产生耐受性中起着重要作用
doi:10.1038/s41586-022-05141-x
在一项新的研究中,来自美国威尔康奈尔医学院等研究机构的研究人员发现一群称为3型天然淋巴细胞(group 3 innate lymphoid cell, ILC3)的免疫细胞在建立对定居在人类胃肠道中的共生微生物的耐受性方面发挥着重要作用。这一发现阐明了肠道健康和粘膜免疫的一个重要方面---这可能是更好地治疗炎症性肠病(IBD)、结肠癌和其它慢性疾病的关键。相关研究结果于2022年9月7日在线发表在Nature期刊上,论文标题为“ILC3s select microbiota-specific regulatory T cells to establish tolerance in the gut”。
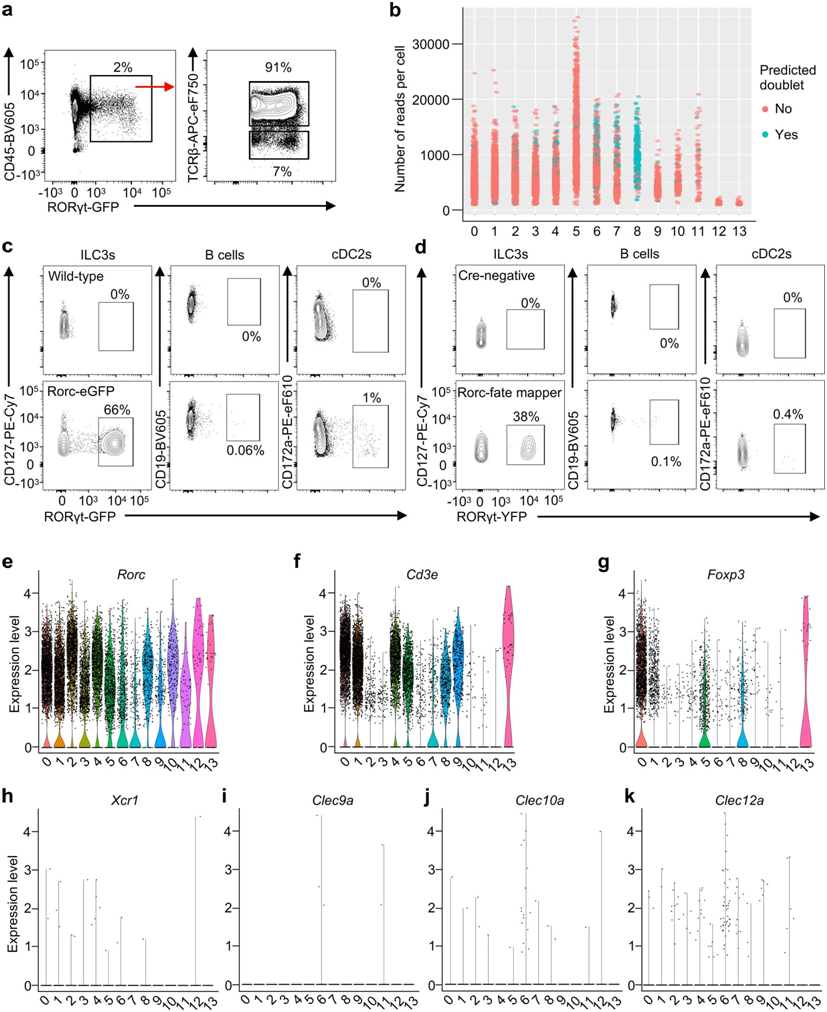
小鼠mLN RORγt+细胞的scRNA-seq分析。图片来自Nature, 2022, doi:10.1038/s41586-022-05141-x。
在这项新的研究中,Sonnenberg及其同事们使用单细胞测序和荧光成像技术来描述排出健康小鼠肠道的肠系膜淋巴结中的免疫细胞。他们专注于表达转录因子RORγt的免疫细胞,这些免疫细胞已知会在对肠道内定植的微生物作出反应时驱动炎症或耐受。他们发现,这些组织中主要的免疫细胞类型是T细胞和ILC3。后者是一个免疫细胞家族,在肠道和肺部等粘膜组织中作为第一道防线发挥作用。
通过与英国伯明翰大学的研究人员密切合作,Sonnenberg及其研究团队观察到,在称为滤泡间区(interfollicular zone)的淋巴结区域,ILC3与一种特定类型的T细胞---称为RORγt+调节性T细胞(Treg)---密切相互作用,从而适应于抑制炎症和免疫活动,以促进肠道中的耐受性。
4.Cell:新研究成功构建出一种由100多种细菌物种组成的合成肠道微生物组,有望开发出微生物组疗法治疗一系列疾病
doi:10.1016/j.cell.2022.08.003
过去十年的关键研究已表明肠道微生物组,即生活在人类消化系统中的成百上千种细菌的集合,影响着神经发育、对癌症免疫疗法的反应以及健康的其他方面。但这些群体是复杂的,如果没有系统的方法来研究其成分,与某些疾病有关的确切细胞和分子仍然是一个谜。
在一项新的研究中,来自美国斯坦福大学的研究人员建立了最复杂和明确定义的合成微生物组(synthetic microbiome),构建出一种由100多种细菌物种组成的细菌群落,并成功将地它们移植到小鼠体内。添加、移除和编辑单个细菌物种的能力将使科学家们更好地了解微生物组与健康之间的联系,并最终开发出一流的微生物组疗法。相关研究结果于2022年9月6日在线发表在Cell期刊上,论文标题为“Design, construction, and in vivo augmentation of a complex gut microbiome”。
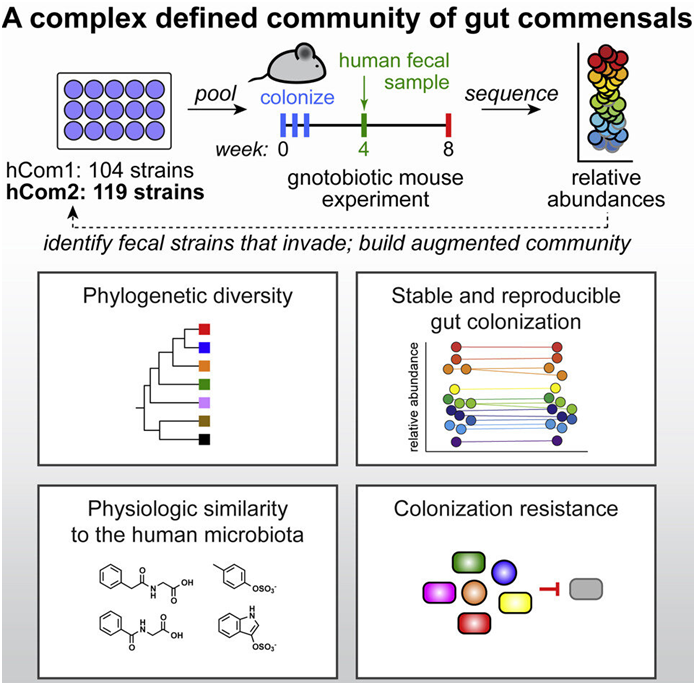
图片来自Cell, 2022, doi:10.1016/j.cell.2022.08.003。
论文共同通讯作者、斯坦福大学的Michael Fischbach设想,这种从头开始构建微生物组的方法将在未来使基于微生物组的工程疗法成为可能。作为斯坦福大学微生物组治疗计划(Microbiome Therapies Initiative, MITI)的负责人,他的目标是构建有朝一日可以移植到人体内以治疗或预防多种疾病的工程化细菌群落。
5.Cell:新研究揭示高糖饮食中的糖破坏肠道微生物组,使哺乳动物易患肥胖、糖尿病和代谢综合征
doi:10.1016/j.cell.2022.08.005
在一项新的针对小鼠的研究中,来自美国哥伦比亚大学和日本庆应义塾大学等研究机构的研究人员发现饮食中的糖改变了肠道微生物组,引发了一连串的事件,最终导致代谢疾病、前期糖尿病(pre-diabetes)和体重增加。这一结果表明,饮食很重要,但最佳的肠道微生物组对于预防代谢综合征、糖尿病和肥胖同样重要。相关研究结果于2022年8月29日在线发表在Cell期刊上,论文标题为“Microbiota imbalance induced by dietary sugar disrupts immune-mediated protection from metabolic syndrome”。
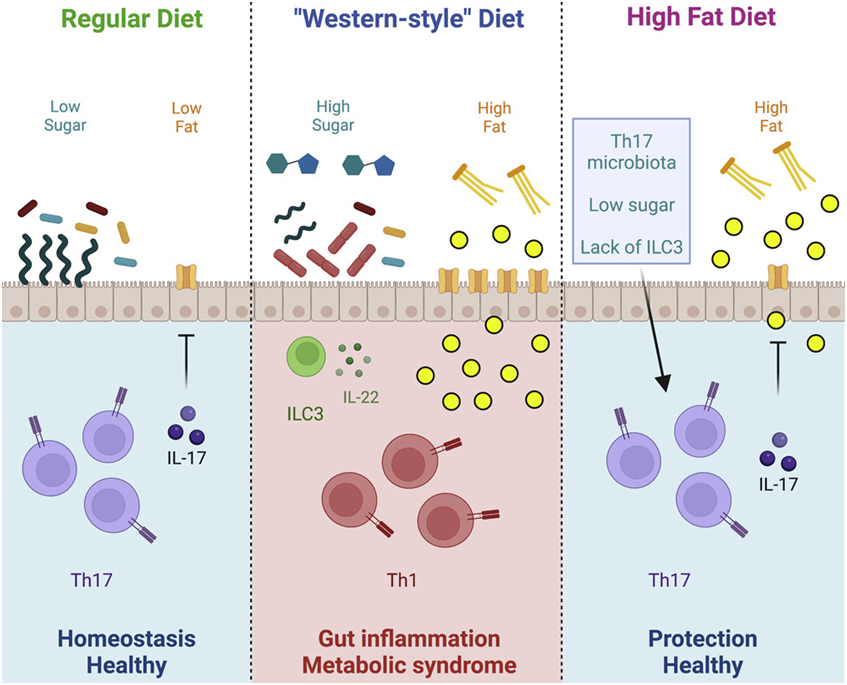
图片来自Cell, 2022, doi:10.1016/j.cell.2022.08.005。
在摄入这种高脂肪、高糖饮食四周后,这些小鼠表现出代谢综合征的特征,如体重增加、胰岛素抵抗和葡萄糖不耐受。它们的肠道微生物组发生了巨大的变化,分段丝状细菌---在啮齿动物、鱼和鸡的肠道菌群中很常见---的数量急剧下降,而其他细菌的丰度增加。
这些作者发现通过对Th17免疫细胞的影响,分段丝状细菌的减少对这些小鼠的健康至关重要。分段丝状细菌的减少降低了肠道中Th17细胞的数量,而进一步的实验显示,正是Th17细胞对于预防代谢性疾病、糖尿病和体重增加是必要的。
高脂肪、高糖饮食中的什么成分导致了这些变化?Ivanov及其研究团队发现,糖是罪魁祸首。Ivanov说,“糖消除了分段丝状细菌,保护性Th17细胞因此而消失伊万诺夫说。当我们给小鼠喂食无糖、高脂肪的饮食时,它们保留了肠道Th17细胞,并被完全保护起来,不会发展成肥胖和前期糖尿病,尽管它们吃的卡路里数量相同。”但消除糖并没有帮助所有的小鼠。在那些一开始就缺乏任何分段丝状细菌的小鼠中,消除糖并没有产生有益的影响,而且这些小鼠变得肥胖并患上了糖尿病。
6.Front Neurol:新研究揭示肠道细菌产生的神经毒素BF-LPS促进阿尔茨海默病产生机制
doi:10.3389/fneur.2022.900048
在一项新的研究中,来自美国路易斯安那州立大学的研究人员首次报告了一种始于肠道、止于脑细胞中的一种强效促炎性毒素的途径,该途径有助于阿尔茨海默病(Alzheimer's disease, AD)的产生。他们还报告了一种预防它的简单方法。相关研究结果近期发表在Frontiers in Neurology期刊上,论文标题为“Downregulation of Neurofilament Light Chain Expression in Human Neuronal-Glial Cell Co-Cultures by a Microbiome-Derived Lipopolysaccharide-Induced miRNA-30b-5p”。
这些作者发现有证据表明,一种含有非常强效的微生物产生的神经毒素---脂多糖(LPS)---的分子,源自人类胃肠道中的革兰氏阴性细菌脆弱拟杆菌(Bacteroides fragilis),能够产生一种称为BF-LPS的神经毒素。
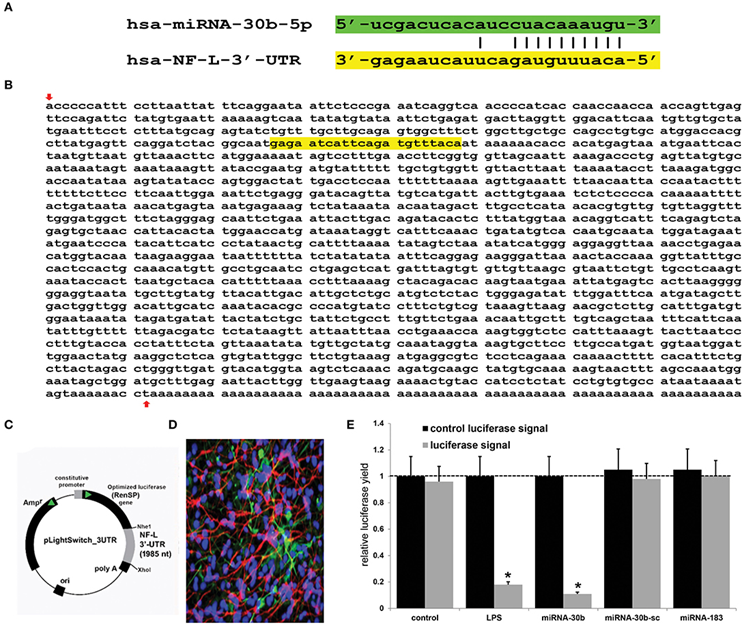
hsa-miRNA-30b-5p (miRNA-30b)与人类NF-L 3'-UTR的相互作用分析。图片来自Frontiers in Neurology, 2022, doi:10.3389/fneur.2022.90004。
在这项新的研究中,这些作者详细说明了BF-LPS从肠道到大脑的途径以及它在大脑中的作用机制。BF-LPS从胃肠道漏出,通过血液循环穿过血脑屏障,并进入大脑区室。它随后增加了脑细胞的炎症,并抑制了神经元特异性神经丝轻链(neurofilament light, NF-L),即一种支持细胞完整性的蛋白。这种蛋白的缺乏导致神经元的渐进性萎缩,最终导致细胞死亡,正如在受AD影响的神经元中观察到的那样。他们还报告说,摄入足够的膳食纤维可以阻止这一过程。
这种新描述的病理途径的新特点有三个方面。这种促进AD的途径始于我们内部---我们的消化道微生物组,因此是非常“本土来源”的,在我们的一生中都很活跃。高强效的神经毒素BF-LPS是消化道微生物代谢的天然副产物。作为神经毒素BF-LPS的来源,肠道微生物组中脆弱拟杆菌的丰度可以通过膳食纤维的摄入来调节。
7.Cell:噬菌体组合疗法有望治疗炎症性肠病等一系列与肠道菌群相关的疾病
doi:10.1016/j.cell.2022.07.003
在一项新的研究中,来自以色列魏茨曼科学研究所和德国癌症研究中心的研究人员首次设计了一种噬菌体组合疗法,它能够精确靶向并抑制与炎症性肠病(inflammatory bowel disease, IBD)相关的肠道细菌。这一发现展示了使用噬菌体治疗与肠道菌群相关的疾病的可能性。相关研究结果发表在2022年8月4日的Cell期刊上,论文标题为“Targeted suppression of human IBD-associated gut microbiota commensals by phage consortia for treatment of intestinal inflammation”。

图片来自Cell, 2022, doi:10.1016/j.cell.2022.07.003。
论文通讯作者、魏茨曼科学研究所系统免疫学部主任、德国国家癌症中心(DKFZ)微生物组与癌症部主任Eran Elinav说,“应用噬菌体疗法的最大问题是细菌和噬菌体之间存在着一场持续的军备竞赛。如果你在针对一种细菌提供单一的噬菌体,该细菌很可能会非常迅速地产生抵抗性。据我们所知,我们是第一个使用口服噬菌体组合疗法来对付一种造成疾病的肠道共生菌,同时解决噬菌体抵抗性这一巨大问题并治疗一种非传染性疾病。”
Elinav和他的团队发现了最有效的噬菌体组合,该组合包含五种噬菌体,在试管中抑制Kp菌株,以及在小鼠IBD模型中,这种噬菌体组合减轻了炎症和组织损伤。
Elinav团队进一步在一项涉及18名健康志愿者的1期临床试验中测试了这种噬菌体组合中的两种代表性噬菌体。实验表明,当与抗酸剂(antacids)一起服用时,这些噬菌体可以在高水平下存活,并在整个胃肠道内保持活性,同时不影响周围的肠道菌群。这些参与者没有出现严重的治疗相关的不良事件。该团队计划在随后的2期试验中针对携带致病性Kp菌株的IBD患者进一步测试这种含有5种噬菌体的组合疗法。此外,Elinav和他的团队正在努力确定与其他疾病相关的细菌,并开发针对它们的有效噬菌体组合疗法。
8.Cell:对从粪便样品中收集的大肠杆菌进行工程化有望治疗糖尿病等疾病
doi:10.1016/j.cell.2022.06.050
科学家们长期以来一直试图将基因工程细菌引入肠道以治疗疾病。在过去,这些尝试主要集中在工程化的普通实验室大肠杆菌菌株上,这些菌株不能与很好地适应宿主的天然肠道细菌竞争。如今,在一项新的研究中,来自美国加州大学圣地亚哥分校的研究人员成功地设计了从人类和小鼠肠道微生物组中收集的大肠杆菌,并表明它们有可能治疗糖尿病等疾病。相关研究结果于2022年8月4日在线发表在Cell期刊上,论文标题为“Intestinal transgene delivery with native E. coli chassis allows persistent physiological changes”。
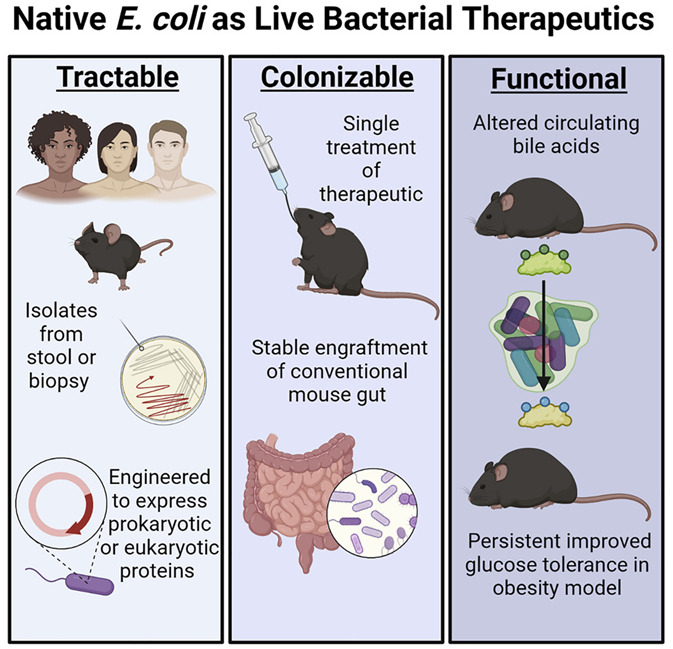
图片来自Cell, 2022, doi:10.1016/j.cell.2022.06.050。
论文通讯作者、加州大学圣地亚哥分校胃肠病学者Amir Zarrinpar说,“我只能对非天然细菌说,祝你好运。肠道微生物组是非常动态的,并且在不断变化,这使得非天然细菌的处境更加艰难。对于以前从未在哺乳动物体内生活过的细菌来说,它们如今进入肠道微生物组丛林,在所有这些为了防止细菌入侵者占据优势的敌对条件下,是很有挑战性的。”
这些作者为这个问题设计了一个解决方案,即直接对从宿主身上收集的大肠杆菌进行工程设计。Zarrinpar说,“我们体内的细菌专门适应我们每个人:我们吃的食物,我们身体经历或诱发的常见压力,以及我们的遗传背景。这种不断波动的环境是它们的正常现象。”这是天然细菌的一大优势,使对它们进行工程化的理想候选对象。
Zarrinpar说,“我们对这些细菌进行了工程设计,使它们成为能够生活在我们的微生物组中并有可能产生药物的工厂。我们知道大肠杆菌可以拾取致病基因并导致疾病,而如今我们刚刚意识到,如果我们导入一个有益的基因,它可以帮助我们治疗慢性疾病,甚至可能治愈一些疾病。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


