JTO:中国科学家+中国创新药,首次证实免疫单药新辅助治疗能为早期肺癌患者带来长期生存获益
来源: 奇点糕 2022-05-24 09:48
作为全球癌症相关死亡的主要原因之一,肺癌是无数家庭和个人心头的阴霾[1]。有研究预测在2022年中国癌症发病总人数将高达482万例,癌症死亡病例高达321万例,其中肺癌是致死人数第一的恶性肿瘤[2]。
作为全球癌症相关死亡的主要原因之一,肺癌是无数家庭和个人心头的阴霾[1]。有研究预测在2022年中国癌症发病总人数将高达482万例,癌症死亡病例高达321万例,其中肺癌是致死人数第一的恶性肿瘤[2]。
传统的肺癌治疗手段包括放疗,化疗和手术治疗。新辅助化疗虽然可以在一定程度上提高患者的五年生存率[3],然而大量接受新辅助化疗的患者出现了乏力、肺炎等不良事件。因此,免疫治疗作为一种临床疗效较好、并发症较少的新兴治疗方法,有望成为新辅助治疗的重要手段[4]。
虽然PD-1抑制剂在多种癌症中已被证明应用安全有效[5],但是目前很少有研究评估PD-1抑制剂用于非小细胞肺癌(NSCLC)新辅助治疗的患者长期预后情况。近日,由国家癌症研究中心、中国医学科学院高树庚教授带领的研究团队在Journal of Thoracic Oncology发表了一项重要的研究成果[6]。
研究首次揭示,在中位时间达到37.8个月的随访中,接受PD-1抑制剂信迪利单抗新辅助治疗的NSCLC患者,3年的整体生存率(OS)为88.5%,3年的无疾病生存率(DFS)为75.0%。其中PD-L1阳性表达的患者,3年的OS和DFS分别为95.5%和81.8%!

文章首页截图
该研究的结果首次证实,新辅助免疫治疗患者的长期OS,显著优于只接受化疗和手术治疗的患者,这表明PD-1抑制剂作为新辅助治疗的重要手段,具有用于可手术NSCLC患者的巨大潜力。
从2018年3月到2019年3月,共计有40名患者被列入本研究随访名单中,这些患者均在手术前使用了2次信迪利单抗,术后则可选择不同的辅助治疗方案。患者在第一次新辅助治疗后的29~43天内接受手术,研究者还通过正电子发射断层成像-计算机断层摄影(PET-CT),评估患者在登记入院时和手术前的肿瘤代谢情况。
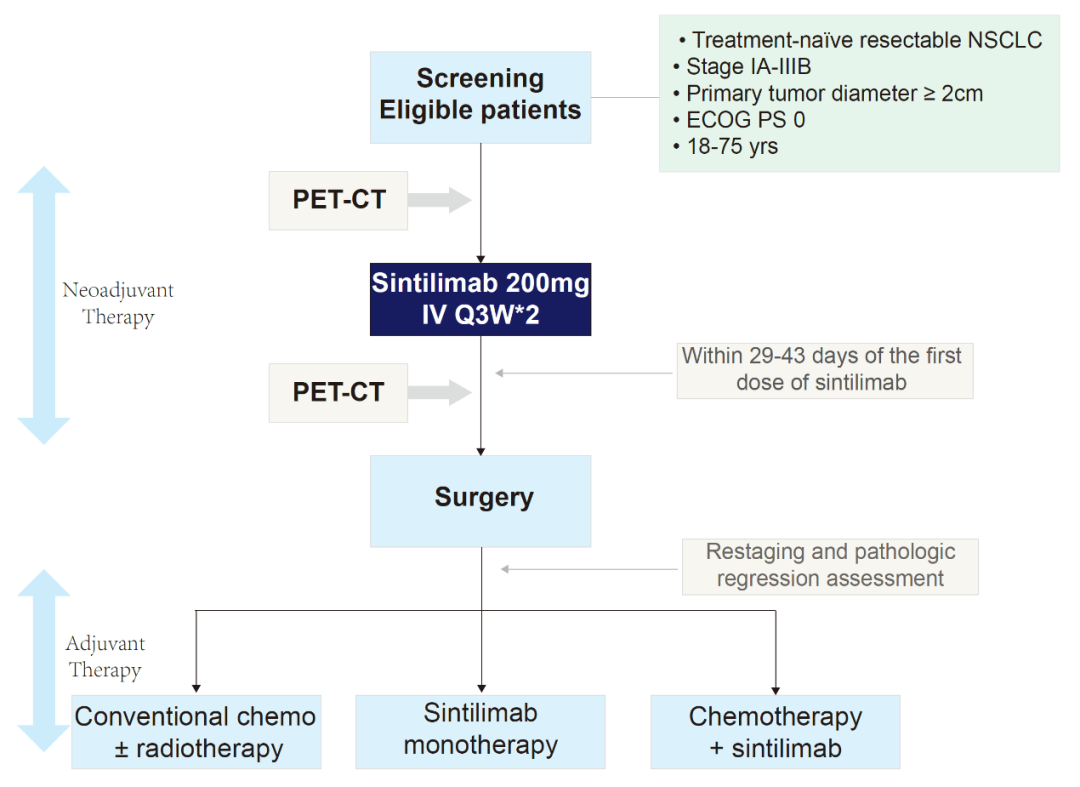
NSCLC患者接受的治疗策略
该研究的主要终点是不良事件(AEs)、非手术延迟率和手术并发症。关键的次要终点是3年总生存率(OS);1年、2年、3年无病生存率(DFS);1年、2年、3年无事件生存率(EFS)和主要病理缓解(MPR)评价。
在36例新辅助治疗患者队列中,共有4例患者死亡,6例复发,患者整体3年的OS率为88.5% (95% CI: 78.5 -99.8) ,3年的DFS率为75.0% (95% CI: 62.1-90.6);在22例PD-L1阳性(TPS≥1%)的患者队列中,1例死亡,3例复发,3年的OS率为95.5% (95% CI: 87.1 -100),3年DFS率为81.8%(95% CI: 67.2-99.6)。
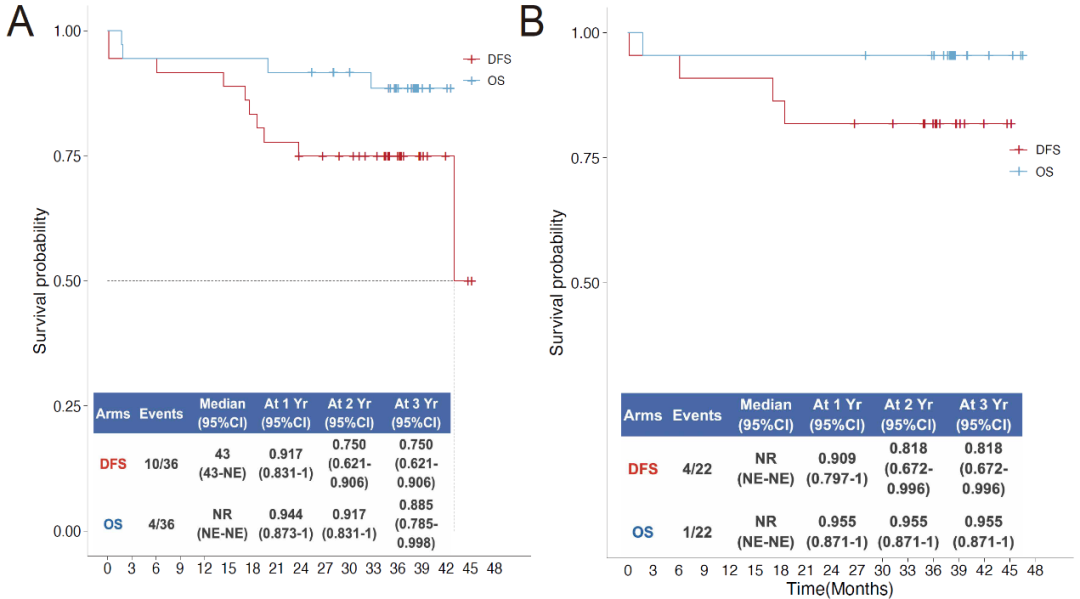
患者三年生存曲线(A)及PD-L1阳性患者生存曲线(B)
为了评估PD-L1表达水平是否可以作为预测患者免疫治疗疗效的因素,研究者将患者分为PD-L1阳性队列(PD-L1表达水平≥1%)和PD-L1阴性队列(PD-L1表达水平<1%)。结果显示,PD-L1阳性队列表现出显著更好的无疾病生存率(P = 0.0325)。
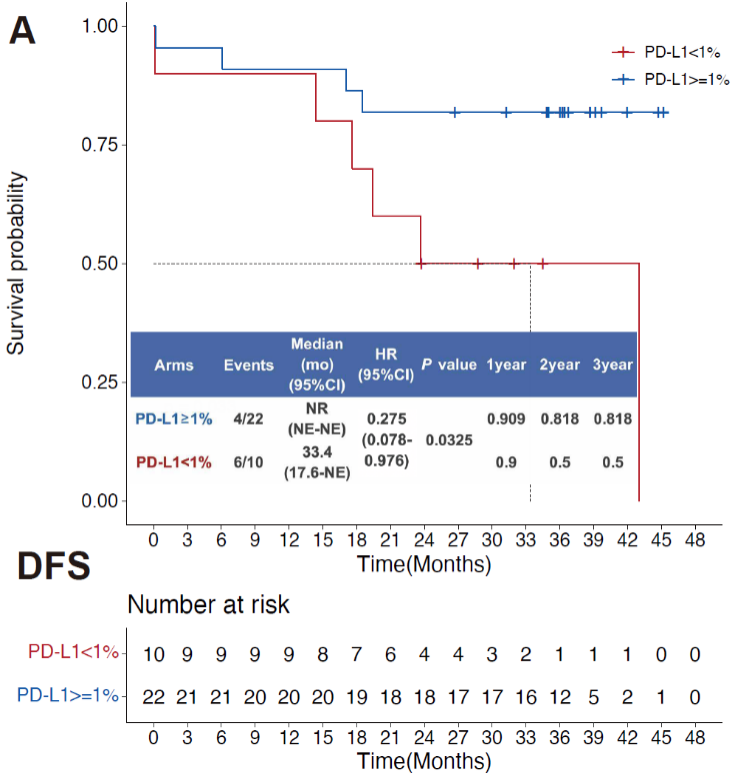
根据PD-L1表达水平划分的无疾病进展生存
为了评估肿瘤突变负荷(TMB)、MPR、病理完全响应( pCR)是否可以作为预测患者新辅助免疫疗效的因素, 研究者将患者分为TMB≥10和TMB<10两组,结果显示TMB较高的患者有DFS更好的趋势(DFS, HR, 0.164 [95% CI, 0.019 - 1.414]; log-rank P = 0.0612);
按同样的模式将患者分为MPR和non-MPR组,也能看到MPR的患者有DFS更好的趋势(DFS, HR, 0.350 [95% CI, 0.074 to 1.652]; log-rank P=0.1656);将患者分为pCR和non-PCR组,pCR的患者有DFS更好的趋势(DFS, HR, 0.499[95% CI, 0.062 to 3.991]; log-rank P = 0.5041)。
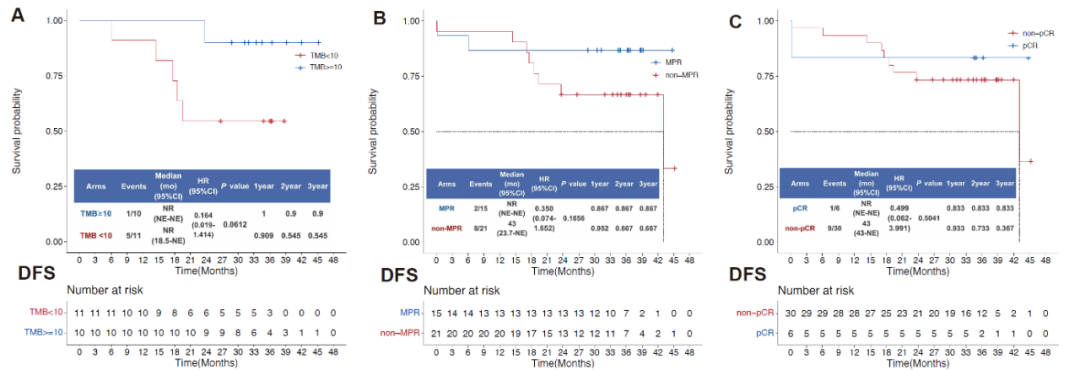
评估TMB,MPR,pCR是否可以作为预测免疫治疗疗效的因素
研究者还通过倾向得分匹配(PSM)的方法,回顾性地从之前接受新辅助化疗及手术治疗(NC-cohort)和前期手术治疗(US-cohort)患者中1:1选择病例,与接受新辅助免疫治疗 (NI-cohort)的患者匹配,比较不同治疗模式患者的预后情况。结果显示,NI-cohort比其他两个队列有更好的预后。
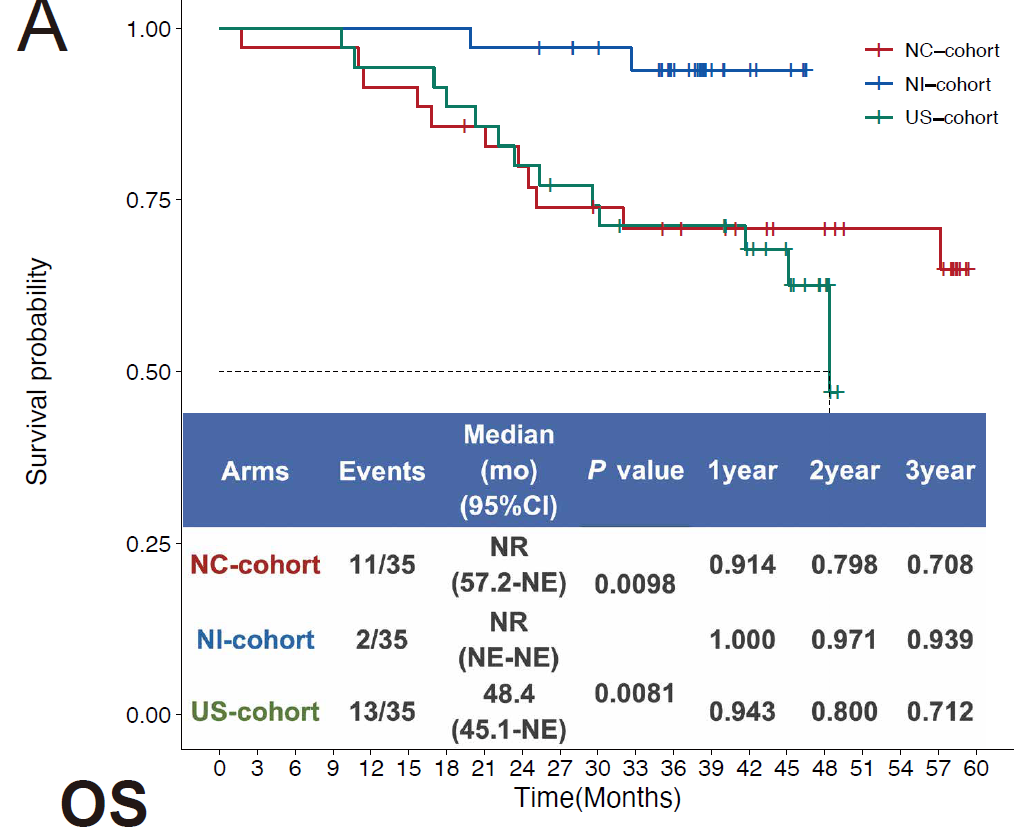
接受不同治疗方式患者的三年预后变化
总而言之,本次研究进一步提示了PD-1抑制剂作为NSCLC新辅助治疗的有效性和可行性,尤其是初步证实了免疫单药治疗的长期生存获益,且免疫新辅助治疗可能对PD-L1阳性、肿瘤突变负荷高的患者具有更好的临床疗效。该研究为使用免疫疗法作为NSCLC的新辅助治疗提供了新的见解。
参考文献:
[1]SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer Statistics, 2021 [J]. CA Cancer J Clin, 2021, 71(1): 7-33.
[2]XIA C, DONG X, LI H, et al. Cancer statistics in China and United States, 2022: profiles, trends, and determinants [J]. Chin Med J (Engl), 2022, 135(5): 584-590.
[3]BURDETT S, PIGNON J P, TIERNEY J, et al. Adjuvant chemotherapy for resected early-stage non-small cell lung cancer [J]. Cochrane Database Syst Rev, 2015, (3): CD011430.
[4]JIA X H, XU H, GENG L Y, et al. Efficacy and safety of neoadjuvant immunotherapy in resectable nonsmall cell lung cancer: A meta-analysis [J]. Lung Cancer, 2020, 147: 143-153.
[5]DOROSHOW D B, SANMAMED M F, HASTINGS K, et al. Immunotherapy in Non-Small Cell Lung Cancer: Facts and Hopes [J]. Clin Cancer Res, 2019, 25(15): 4592-4602.
[6]ZHANG F, GUO W, ZHOU B, et al. Research article: Three-year Follow-up of Neoadjuvant PD-1 inhibitor (Sintilimab) in Non-Small Cell Lung Cancer [J]. J Thorac Oncol, 2022.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


