Cell论文详解:通过植物免疫蛋白挽救miRNA缺陷,实现广谱抗肿瘤反应
来源:生物世界 2022-06-21 13:37
该研究阐明了植物免疫蛋白 RDR1 抑制癌细胞细胞周期的机理,为开发新的癌症治疗方案提供了潜在的研究方向。
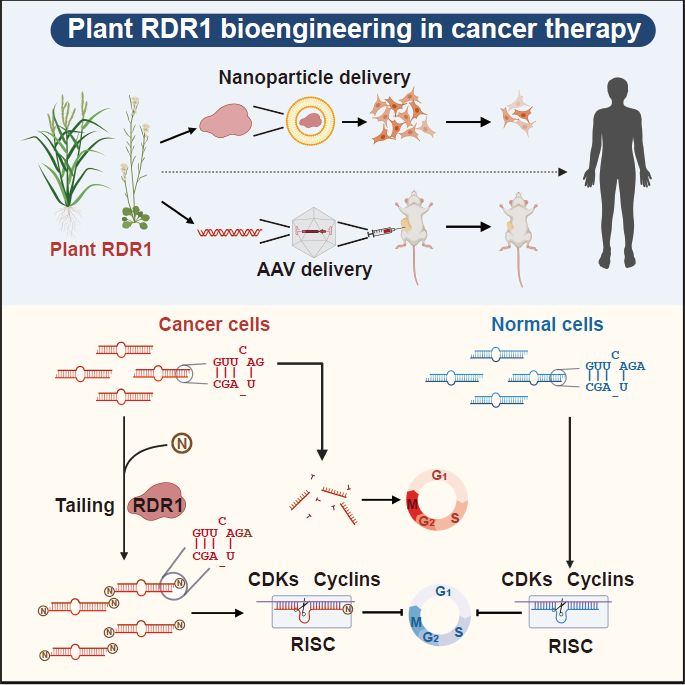
图1:植物RDR1修复缺陷miRNA实现抗肿瘤作用模式图(图片来自原文)
在本研究工作中,作者主要有以下发现:
1、RDR1蛋白通过靶向细胞周期广泛抑制癌细胞的增殖
为了在哺乳动物细胞中进行基于植物RDR1的生物工程,作者分别从拟南芥(At)和水稻(Os)中克隆RDR1基因到基于Dox诱导的慢病毒载体上。最终,本研究获得了13个稳定的RDR1诱导细胞系(包括7个实体瘤、3个白血病、3个非癌症细胞系)和2个RDR1恒定表达的胚胎干细胞系。通过Western blot和活细胞成像,作者验证了RDR1在哺乳动物细胞中成功实现了异位表达。
在接下来的研究中,令作者惊讶和意外的是,AtRDR1和OsRDR1能够在体外显著抑制所有10种癌症细胞系的增殖,但对其他5种非癌细胞没有影响。RDR1还可以显著抑制癌细胞的克隆形成能力。在分子水平上,基于RNA-seq的基因集富集分析(GSEA)表明,AtRDR1和OsRDR1可以干扰所有癌症细胞系中的细胞周期过程,但在非癌对照细胞中没有明显作用。值得注意的是,短时间(2-3天)诱导RDR1同样可显著抑制癌细胞中的细胞周期过程,表明细胞周期通路可能是RDR1的直接作用靶点。随后,EdU/PI染色分析显示,RDR1在癌细胞中的表达显著降低了S期的细胞比例,反而增加了G0/G1期的细胞比例。因此,作者认为植物免疫蛋白RDR1是一种外源肿瘤抑制因子,它能够特异靶向并干扰癌细胞中的细胞周期过程,但在非癌症细胞中却不起作用。
2、在3’末端短1个碱基的受损的miRNA异构体在多种肿瘤中广泛积累
由于RDR1参与植物中的小RNA通路,作者在RDR1诱导表达前后的癌症和非癌症细胞中进行小RNA 测序。令人惊讶的是,作者发现诱导RDR1后的癌症细胞中miRNA的整体表达明显增加,但在非癌症细胞系中却没有出现这种现象。随后,作者还通过miRNA通路关键组分的敲低和AGO2-CLIP等实验,提出植物RDR1通过提高全局miRNA表达以特异挽救癌细胞中的miRNA缺乏来抑制细胞周期和增殖。
为了进一步研究RDR1特异靶向癌细胞的机制,作者对已公开发表的小RNA测序数据进行系统分析,包括TCGA数据库的9980组癌症病人数据以及GEO数据库的癌症病人、癌症细胞系以及正常组织的数据。结果表明,在很多癌症病人和细胞系的样本中,在3’末端短1-nt的miRNA异构体出现了大量的积累。这些3’末端短1-nt的miRNA在部分癌症样本中甚至成为不同miRNA异构体中数量最多的群体。由于AGO蛋白结构的特殊性,2-nt悬垂的结构有利于miRNA双链进入AGO2中形成RISC 。作者提出,这种1-nt悬垂的异构体,相比于2-nt悬垂的异构体进入AGO2的效率更低,并通过EMSA和MST实验进行了验证。同时,通过AGO2-IP的小RNA测序,作者进一步分析发现3’末端短1-nt的miRNA异构体在Input组更富集,进一步表现出短1-nt的miRNA异构体进入AGO2的效率更低。综上,作者提出,在癌细胞中,这种短1-nt的异常miRNA双链异构体不能有效地进入到AGO2中,并且不稳定,因此可能与不同肿瘤中的miRNA剂量减少有关。
3、RDR1通过单核苷酸加尾修复癌症中有问题的miRNA异构体
据报道,植物RDR6同时具有RNA聚合酶和核苷酸转移酶活性,而在后续的小RNA测序数据分析中,作者发现具有3’端单核苷酸加尾的成熟miRNA特异富集于RDR1异位表达的癌症细胞中。有趣的是,这种单核苷酸加尾主要出现在3’末端短1-nt的miRNA上,但很少出现在注释的切割末端上。随后作者在大肠杆菌中纯化出重组的rAtRDR1和酶活位点突变的3DA mutant rAtRDR1。通过体外生化实验,作者直接证明了rAtRDR1能够对单链miRNA和具有1-nt或2-nt悬垂的miRNA双链进行3’末端单核苷酸修饰,但不能修饰具有平末端的miRNA双链。
结合以上的发现,作者设想RDR1倾向于识别AGO2中游离出来的具有1-nt悬垂的miRNA双链作为底物,这些异构体尤其在癌症细胞中积累,但在非癌症细胞中不积累,并用单核苷酸加尾修饰这些有问题的miRNA。为了验证这一点,作者首先在表达RDR1的肺癌A549细胞中进行了AGO2敲低实验,随后进行小RNA序列分析。正如预期的那样, AGO2缺失确实进一步加强了RDR1介导的miRNA修饰,在癌细胞中短1-nt的miRNA异构体上单核苷酸加尾的比例大幅提高。之后,体外将rAGO2与具有1-nt/2-nt悬垂的miRNA双链预孵育后再加入rRDR1进行游离miRNA双链的加尾实验,结果显示与AGO2亲和力较低的1-nt悬垂的miRNA双链在与rAGO2蛋白预孵育后更倾向于被RDR1修饰。
最后,作者还通过给1-nt悬垂的miRNA双链加尾后的重新结合,1-nt/2-nt外源miR-34c双链的体外转染等实验和分析,共同证明了RDR1拥有核苷酸转移酶活性,能够对AGO2中游离出的短1-nt的miRNA双链异构体进行单核苷酸修饰,以恢复这些异构体对AGO2的装载效率,并最终修复癌症中有缺陷的miRNA通路。
4、RDR1抑制多种小鼠实体瘤和白血病的进展
接下来,作者想在小鼠体内验证植物RDR1的抗肿瘤作用。首先,作者将RDR1诱导型癌症细胞系注射免疫缺陷小鼠以进行体内荷瘤实验,并且通过Dox喂水以实现RDR1的异位表达。结果表明,野生型而非突变型RDR1显著抑制了所成肿瘤的大小、体积和重量。作者还发现,在A549,H1299和PC-3细胞所成的荷瘤中,植物RDR1能够显著提高癌细胞中miRNA的表达,从而抑制了癌细胞的细胞周期。
类似的,作者还评估了RDR1在体内白血病小鼠模型中的抗肿瘤作用。与载体对照或突变的RDR1相比,野生型RDR1能够显著抑制三种白血病细胞系(Jurkat、K562和NALM6)在免疫缺陷小鼠外周血中的增殖,并最终延长异种移植小鼠的寿命。同样,RDR1可以在体内显著增加白血病细胞中的miRNA表达以抑制白血病细胞中的关键细胞周期组分,包括CDK1、CCNE2、PLK1、CDK6等,从而抑制细胞周期。
最后,通过纳米囊泡包装体外纯化的RDR1蛋白和AAV包装的RDR1,分别在体外细胞和体内实体瘤水平上实现了RDR1的直接递送和肿瘤抑制。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


