《自然》重磅:肿瘤免疫屏蔽场的“操盘手”,终于被抓住了!华人科学家领衔的团队发现,癌细胞脱落的一种分子能帮肿瘤构建免疫逃逸系统
来源:奇点糕 2021-11-10 18:56
近日,由乔治·华盛顿大学的Li Rong和德克萨斯大学的An Zhiqiang等领衔的研究团队,在顶级期刊《自然》发表重磅研究成果。他们发现,在癌症进展过程中,一种被称为DDR1的分子会释放其胞外结构,组织胶原纤维在肿瘤周边形成致密的免疫屏蔽结构,阻止免疫细胞进入肿瘤。而特异性抑制DDR1胞外结构的活性,免疫细胞可以渗入肿
近日,由乔治·华盛顿大学的Li Rong和德克萨斯大学的An Zhiqiang等领衔的研究团队,在顶级期刊《自然》发表重磅研究成果。
他们发现,在癌症进展过程中,一种被称为DDR1的分子会释放其胞外结构,组织胶原纤维在肿瘤周边形成致密的免疫屏蔽结构,阻止免疫细胞进入肿瘤。而特异性抑制DDR1胞外结构的活性,免疫细胞可以渗入肿瘤,并杀死里面的癌细胞。
An Zhiqiang等认为,发现DDR1在癌症耐药性中的重要作用是一项重大进展,有可能改变癌症治疗途径。
在三阴性乳腺癌(TNBC)等多种恶性肿瘤中,免疫排斥与患者的不良预后有关。已经有很多研究表明,细胞外基质(ECM)有助于免疫排斥的发生。然而,减少ECM的策略要么无效,要么会产生不希望看到的结果。
Li Rong团队注意到,有一个叫做盘状结构域受体1(DDR1)的受体酪氨酸激酶,它的表达增加与包括乳腺癌在内的多种癌症的进展相关[7]。遗憾的是,DDR1促进肿瘤进展和转移的机制,还知之甚少[8,9]。不过,我们知道的是,DDR1在细胞的黏附,增殖及细胞外基质的重塑中起重要作用。
因此Li Rong团队将DDR1作为研究的重点。
为了研究DDR1的促癌机制,Li Rong团队在三种TNBC小鼠模型(E0771、M-Wnt和AT-3)中,特异性删除了Ddr1基因。
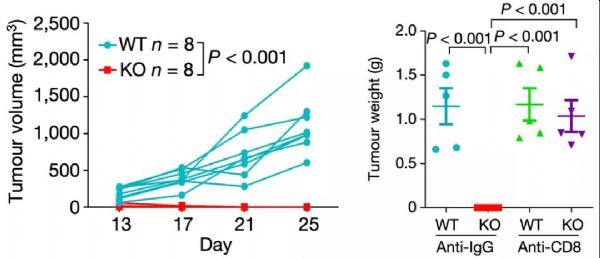
他们发现,Ddr1的敲除(KO)不损害癌细胞在体外的增殖,也不影响癌细胞在免疫缺陷宿主体内生长。不过,Ddr1-KO肿瘤在免疫功能正常的宿主体内不能生长。如果耗尽CD8+细胞的话,Ddr1-KO肿瘤就能正常生长,长势与对照的野生型(Ddr1-WT)肿瘤一样旺盛。
还有个让研究人员意外的发现是:将CD8+ T细胞分别转移到免疫缺陷的荷瘤小鼠体内,与野生型Ddr1-WT肿瘤相比,更多的CD8+ T细胞浸润到了Ddr1-KO肿瘤中。而且,原本在免疫缺陷鼠身上一样茁壮生长的Ddr1-KO和Ddr1-WT肿瘤,变得大小不一样了,Ddr1-KO明显变小了。
这些结果表明,DDR1阻碍了小鼠的抗肿瘤免疫能力。
进一步的分析之后,Li Rong团队发现,原来DDR1仅仅是阻碍了T细胞的浸润,而不是影响T细胞的增殖或细胞毒性功能。更直观地看,Ddr1-WT肿瘤将CD8+ T细胞拒之门外,更多的CD8+ T细胞聚集在肿瘤的边缘;而Ddr1-KO肿瘤的核心被更多的CD8+ T细胞渗透、浸润。这进一步证明:DDR1限制了T细胞的浸润。
为了验证以上的发现,Li Rong团队又分析了一些临床样本。他们发现,与肿瘤边缘相比,DDR1水平高的肿瘤内部的CD8+ T细胞丰度较低。相比之下,DDR1低的肿瘤在肿瘤核心和肿瘤边缘的CD8+ T细胞丰度方面没有任何明显的差异。
而且,当这个队列按核心和边缘的相对CD8+ T细胞密度分层时,所有具有免疫排斥表型的肿瘤都是DDR1水平高,而大多数非免疫排斥的肿瘤是DDR1水平低。
这些临床数据共同支持了他们的临床前发现:DDR1排除了抗肿瘤免疫细胞。
那么CD8+ T细胞为啥不能进到DDR1高水平的肿瘤内部呢?
Li Rong团队打算从头捋起。
一般来讲,CD8+ T细胞浸润肿瘤有三关:血管外渗、肿瘤诱导的趋化作用和穿越细胞外基质(ECM)。
将Ddr1-WT肿瘤和Ddr1-KO肿瘤对比一番之后,Li Rong和他的同事发现:二者的血管无甚差异;肿瘤本身除了DDR1水平之外,在趋化因子和抗原等方面也没有差异。
为了进一步挖掘信息,研究人员甚至还比较了Ddr1-WT肿瘤和Ddr1-KO肿瘤,分别在免疫缺陷小鼠、免疫正常小鼠和体外条件下的转录组差异。
汇总所有的信息之后,Li Rong和他的同事发现,所有的信息似乎都指向了肿瘤基质细胞。或许该研究研究DDR1缺失对这个群体的影响了。
遗憾的是,他们没有发现DDR1缺失对肿瘤基质细胞有显着的影响。看来还是得回到DDR1本身。
前面我们介绍过,DDR1是一个跨膜的受体酪氨酸激酶,它的胞外结构域(DDR1-ECD)能与胶原蛋白结合,触发下游的信号传导事件[10]。既然毫无头绪,那就一点点研究DDR1的各部分功能。
Li Rong团队注意到,在Ddr1-KO肿瘤中表达全长的DDR1或删除了激酶结构域的DDR1(ΔKD),都能恢复Ddr1-KO肿瘤在免疫正常小鼠体内的生长。值得注意的是,同时缺乏跨膜和激酶结构域的DDR1-ECD,竟然也能支持Ddr1-KO肿瘤的生长。
不难看出,DDR1结合胶原蛋白的能力,极有可能是促进肿瘤生长的关键。
为了确认这一发现,Li Rong和他的同事给DDR1-ECD引入基因突变。他们发现,那些没有损害DDR1-ECD结合胶原蛋白能力的变异,不会损害DDR1-ECD促进肿瘤生长的能力;而破坏了DDR1-ECD结合胶原蛋白能力的变异,会导致DDR1-ECD促进肿瘤生长的能力大幅下降。
总的来说,以上数据表明,DDR1的胶原蛋白结合能力——而不是其激酶活性——是促进肿瘤在免疫能力强的小鼠体内生长所必需的。
那么DDR1的胞外结构域(DDR1-ECD)又是如何帮助肿瘤屏蔽免疫细胞的呢?
这个时候,Li Rong和他的同事注意到,之前已经有研究发现表达DDR1的细胞会脱落DDR1-ECD[11],而且多聚体形式的DDR1-ECD能重塑胶原纤维[12]。
但是这一现象的生物学意义仍不为人知。或许这就是突破口。
通过进一步观察,Li Rong团队发现,Ddr1-WT肿瘤边缘的胶原纤维长而整齐,而Ddr1-KO肿瘤的胶原纤维短、不整齐,且分散。神奇的是,在免疫缺陷小鼠身上,Ddr1-WT肿瘤和Ddr1-KO肿瘤的胶原纤维,无论是长度还是排列都没有差异。这意味着胶原纤维的这种变化,是肿瘤与免疫系统之间交战的结果。
随后,Li Rong和他的同事发现,瘤内注射正常的DDR1胞外结构域能增强胶原蛋白纤维的排列,抑制免疫细胞浸润;而注射DDR1胞外结构域的功能缺失突变体就没有这个效果。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。