新冠疫苗究竟对我们的免疫力做了什么?Sci Immunol:科学家揭示COVID-19疫苗如何重塑机体淋巴结的微环境
来源:生物谷原创 2025-08-21 10:33
本研究通过多模态生物成像和单细胞转录组学等前沿技术揭示了COVID-19疫苗对淋巴结基质细胞的早期影响。
“打完疫苗胳膊酸了三天,摸起来还有个小硬块 —— 这疫苗是不是太‘猛’了?”
如果你有过这样的经历,别担心,这可能不是疫苗在“搞破坏”,而是你的免疫系统正在“搭戏台”。我们都知道,疫苗的作用是训练免疫系统识别病毒,但很少有人知道,这场“训练”的第一站不是血液,也不是脾脏,而是我们脖子、腋下那些不起眼的淋巴结。
就像演唱会需要舞台、灯光、音响才能顺利进行,免疫系统的 “练兵” 也需要淋巴结里的“基础设施”——基质细胞。这些细胞就像舞台搭建工,负责铺设免疫细胞的 “迁徙通道”、释放 “导航信号”(趋化因子),还得搭建 “抗原展示台”。但问题是:不同的疫苗(比如 mRNA 疫苗、腺病毒载体疫苗、传统蛋白疫苗),会让这些 “舞台搭建工” 干出不一样的活吗?
之前,科学家们更多关注疫苗如何激活免疫细胞(比如 B 细胞、T 细胞),却很少盯着这些“幕后工作者”——淋巴结基质细胞。而这篇发表在《Science Immunology》的研究,就第一次扒开了这个“幕后故事”:不同 COVID-19 疫苗会让淋巴结基质细胞上演截然不同的 “剧本”,有的快速 “布景”,有的 “慢工出细活”,甚至还会影响后续免疫反应的 “剧情走向”。

为啥要盯着淋巴结基质细胞?
淋巴结是免疫系统的 “指挥中心”,而基质细胞是这个中心的 “基建队”。它们包括淋巴管内皮细胞(LECs)、血管内皮细胞(BECs)和成纤维网状细胞(FRCs),负责三件大事:
1. 铺设 “道路”:让免疫细胞(比如 dendritic cells,树突状细胞)能精准移动;
2. 释放 “信号”:用趋化因子给免疫细胞 “导航”;
3. 搭建 “支架”:在免疫反应时支撑淋巴结扩张,还能 “过滤” 淋巴液里的抗原。
但不同疫苗(基因疫苗靠核酸,蛋白疫苗靠直接注射抗原)进入体内后,会不会对这些“基建队”产生不同影响?这直接关系到疫苗的效率和副作用——比如有的疫苗局部反应明显,可能就是基质细胞“加班”导致的。这正是研究团队想弄明白的:不同 COVID-19 疫苗如何“指挥”淋巴结基质细胞,进而影响免疫反应的启动?
实验对象
研究团队给小鼠要么皮下注射(模拟皮肤接种),要么肌肉注射(模拟人类常规接种),然后在不同时间点(2 小时、6 小时、24 小时、30 小时等)“拆解” 引流淋巴结(比如腘淋巴结),用三种“放大镜”观察:
多模态成像:看 S 蛋白在哪里产生,细胞结构有啥变化;
单细胞转录组:“偷听”细胞里的基因在“说什么”(哪些基因被激活);
功能实验:测试基质细胞的 “干活能力”——比如能不能清除抗原、能不能引导免疫细胞移动。
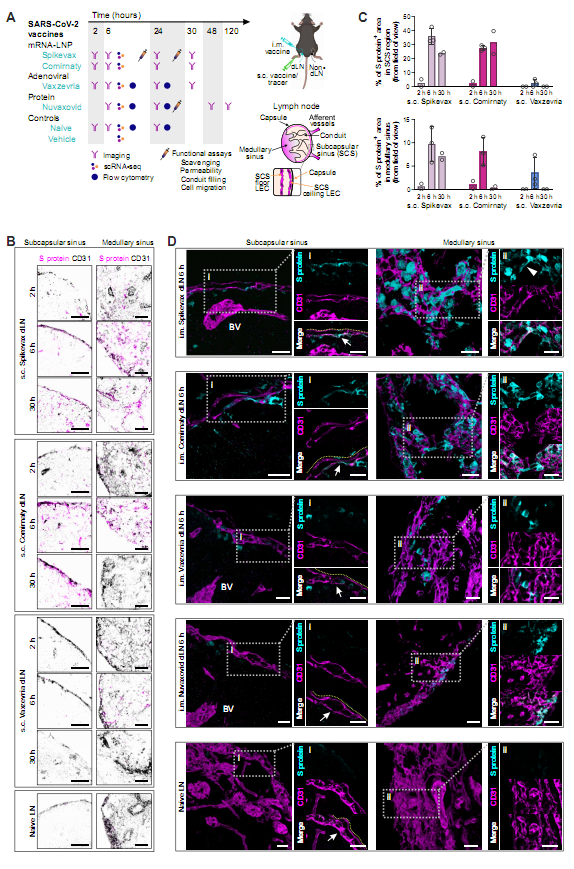
图1:接种基于基因的COVID-19疫苗后,染色淋巴结的基质细胞中存在SARS-CoV-2的S蛋白
不同疫苗,给基质细胞 “改了不同的剧本”
研究团队发现,这四种疫苗就像四个不同的 “导演”,给淋巴结基质细胞安排了完全不同的 “戏份”。
第一幕:基因疫苗让基质细胞 “自己产抗原”,蛋白疫苗只能 “等抗原上门”
打疫苗后,免疫系统首先要 “看到” S 蛋白才能启动反应。但不同疫苗让 S 蛋白出现的方式完全不同:
mRNA 和腺病毒疫苗(基因疫苗):直接 “命令” 淋巴结里的基质细胞 “自己生产 S 蛋白”。比如 mRNA 疫苗会转染淋巴管内皮细胞(LECs)—— 尤其是淋巴结被膜下窦的 “地板细胞”(SCS floor LECs),这些细胞 6 小时内就开始合成 S 蛋白,而且 mRNA 疫苗的 “产能” 比腺病毒疫苗更持久(mRNA 疫苗 30 小时还能检测到,腺病毒疫苗则很快消失)。
蛋白疫苗(Nuvaxovid):只能靠注射的 S 蛋白慢慢 “渗” 进淋巴结,所以基质细胞里几乎测不到 S 蛋白。
正如上图 所示,mRNA 疫苗(Spikevax、Comirnaty)在 6 小时时,淋巴结的被膜下窦和髓窦里全是 S 蛋白,而腺病毒疫苗(Vaxzevria)虽然也有,但持续时间短,蛋白疫苗则 “存在感极低”。这说明:基因疫苗能让淋巴结 “就地生产抗原”,相当于 “主场作战”,而蛋白疫苗更像 “客场送抗原”,效率和持续性都差一截。
第二幕:基质细胞的 “基因剧本” 被改写,功能大变身
疫苗不仅让基质细胞 “产抗原”,还改写了它们的 “工作手册”(基因表达)。单细胞转录组分析发现,不同疫苗激活的基因完全不同:
基因疫苗:强烈激活 “抗病毒基因”(比如干扰素相关基因)和 “抗原处理基因”(比如 Tap1、Tapbp)。尤其是腺病毒疫苗,还会让基质细胞高表达 PD-L1—— 一种调节免疫反应的 “刹车蛋白”,可能是为了避免免疫反应太 “亢奋”。
蛋白疫苗:更倾向于激活 “炎症相关基因”,但对抗病毒基因影响很小。
这些基因变化直接导致基质细胞的 “干活方式” 大变,包括:
1. 抗原清除能力:mRNA 疫苗让 LECs 的 “清道夫受体”(比如 MARCO、MRC1)表达下降 50% 以上,就像 “垃圾清洁工” 集体下班,导致淋巴结里的抗原清除变慢(图 4 显示,mRNA 疫苗接种后,淋巴结对葡聚糖的清除能力下降 60%-93%)。这其实是好事——抗原在淋巴结里待得久一点,能让更多免疫细胞 “看到”。
2. “导航系统” 失灵:所有疫苗都会让淋巴管内皮细胞的 ACKR4 蛋白减少。ACKR4 是 “趋化因子导航仪”,负责维持 CCL21 的梯度(免疫细胞的 “指南针”)。它一减少,免疫细胞的 “导航” 就乱了,但有趣的是,树突状细胞(DCs)似乎找到了 “备用路线”,迁移不受影响。
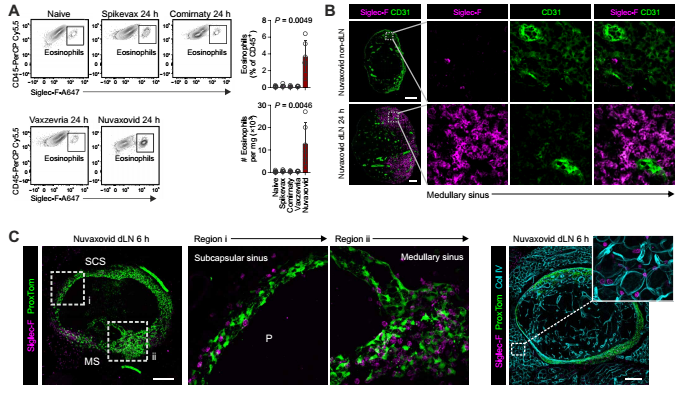
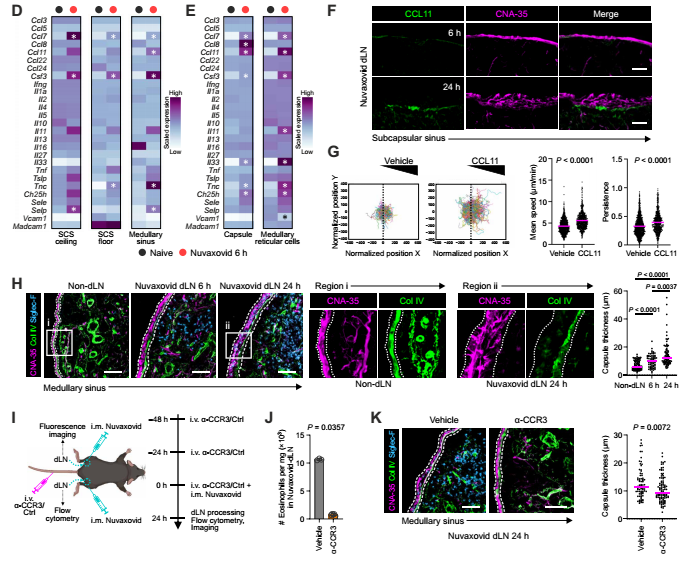
图2:Nuvaxovid诱导的嗜酸性粒细胞浸润调节淋巴结间质
第三幕:蛋白疫苗召唤 “特殊嘉宾”——嗜酸性粒细胞
最戏剧化的差异出现在蛋白疫苗(Nuvaxovid)组:接种后 6 小时,淋巴结里突然涌进大量嗜酸性粒细胞(一种免疫细胞,平时和过敏相关)。这些细胞不是从血管或淋巴管进来的,而是“钻”过淋巴结的被膜,像“空降兵”一样进入髓窦区域。
为啥会这样?原来蛋白疫苗让基质细胞大量分泌 CCL11(嗜酸性粒细胞的“邀请函”),还让淋巴管内皮细胞表达P-选择素(“黏合剂”),专门 “抓” 嗜酸性粒细胞。这些嗜酸性粒细胞来了之后,还会“改造舞台”——让淋巴结被膜变厚,胶原蛋白结构变松散(图2)。当研究人员用抗体“赶走”嗜酸性粒细胞后,这些结构变化居然逆转了,说明嗜酸性粒细胞是蛋白疫苗引发淋巴结结构改变的 “主力”。
小结
综上,本研究通过多模态生物成像和单细胞转录组学等前沿技术揭示了COVID-19疫苗对淋巴结基质细胞的早期影响。研究结果表明,mRNA疫苗和腺病毒载体疫苗能特异性地转染淋巴结基质细胞从而诱导S蛋白的表达并引发转录组重编程,这些变化不仅会影响淋巴结的抗原清除和趋化因子梯度形成,还可能通过改变基质细胞的微环境来增强免疫反应。
总之,这些看似复杂的 “操作”,本质上都是为了一个目标:让你的免疫系统在真病毒来袭时,能喊出那句底气十足的 “我熟!”。(生物谷Bioon.com)
参考文献:
RUTH FAIR-MÄKELÄ,PINJA THORÉN,JONI NÄSIAHO, et al. COVID-19 vaccine type controls stromal reprogramming in draining lymph nodes, Science Immunology (2025). DOI:10.1126/sciimmunol.adr6787
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


