《科学·转化医学》:量小却持久,这个新CAR-T真可以有
来源:奇点糕 2022-01-13 16:37
嵌合抗原受体T细胞疗法(CAR-T)在治疗血液系统肿瘤方面得天独厚,效果卓绝。虽然在临床治疗上的有效率很高,但效果的持续性一直是一大问题。以弥漫性大B细胞淋巴瘤(DLBCL)为例,60-70%的病人在接受靶向CD19的CAR-T治疗后,都无法长期维持临床效果。从以往急性淋巴细胞白血病的大量治疗案例中可知,治疗失效的原因千差万别:抗原丢
嵌合抗原受体T细胞疗法(CAR-T)在治疗血液系统肿瘤方面得天独厚,效果卓绝。虽然在临床治疗上的有效率很高,但效果的持续性一直是一大问题。
以弥漫性大B细胞淋巴瘤(DLBCL)为例,60-70%的病人在接受靶向CD19的CAR-T治疗后,都无法长期维持临床效果。从以往急性淋巴细胞白血病的大量治疗案例中可知,治疗失效的原因千差万别:抗原丢失,T细胞植入成功率不足,T细胞缺乏持续性等等。
如何才能提高T细胞的植入成功率和持久性,从而改善CAR-T的缺陷,达到稳定的抗癌效果呢?
近日,《科学·转化医学》杂志发表了宾夕法尼亚大学Christopher Garcia和Michael Milone实验室在攻克这一难题上的研究成果[1]。他们用基因改造手段设计了一对IL-2配体受体的正交配对,使改造升级后的CAR-T细胞能够特异性地提升植活率和抗肿瘤能力。
让我们先来回顾一下IL-2的前世今生。
调节免疫功能的细胞因子,是免疫系统的重要组成部分。在T细胞释放的众多细胞因子中,IL-2属于核心成员,能通过自分泌和旁分泌途径,调节T细胞的增殖分化。因为这一特性,IL-2常用于辅助T细胞体外扩增。然而,毒性是IL-2细胞因子疗法在临床上无法广泛使用的拦路虎。
为了避免严重的毒副反应,Christopher Garcia研究组于2018年基于进化策略,设计了一套小鼠IL-2配体受体的正交体系[2]。所谓正交配对,说的是经过突变改造后,这一对受体配体之间有特异性相互作用,并且和野生型的受体配体之间彼此独立互不干扰。
他们已经在小鼠体内证实了这套系统可以有效地增强特异性表达正交受体的T细胞,同时不影响其他表达正常IL-2受体的细胞,在小鼠中不会产生野生型IL-2那样的毒副作用。
那么这一成果是不是可以在人类身上实现呢?
为了得到人源的IL-2正交对,Garcia研究组首先用氨基酸替代法进行点突变,IL-2受体的IL-2Rβ链经过His133Asp和Tyr134Phe的点突变改造,成为失去与野生型IL-2结合能力的ortho-hIL-2Rβ。
然后是改造并筛选出相应的ortho-hIL-2,标准是跟ortho-hIL-2Rβ高度亲和,但不理野生型IL-2Rβ。经过层层选拔,综合小鼠和人类序列中的所有点突变,优中选优,最终得到的ortho-hIL-2特异性极高,而且还不影响与IL-2Rα的结合。
接下来要验证一下IL-2/IL-2Rβ正交对的生物学功能是否健全。依赖于IL-2生长的细胞,在表达了ortho-hIL-2Rβ之后,用ortho-hIL-2来“喂养”可以正常生长,所需浓度也和野生型IL-2相仿。
我们都知道,IL-2主要掌管3条通路:JAK-STAT,PI3K/AKT/mTOR和MAPK/ERK。在改造后的ortho-hIL-2Rβ+CAR-T细胞中,ortho-hIL-2对这几条通路的激活和磷酸化水平也都和野生型IL-2差不多。在Nalm6肿瘤细胞的反复刺激下,接受ortho-hIL-2治疗的ortho-hIL-2Rβ+CAR-T细胞仍能持续增长,也能正常生产细胞因子。
那么,IL-2/IL-2Rβ正交体系下的CAR-T在体内的效果如何呢?Garcia研究组研究使用了B细胞急性淋巴白血病(B-ALL)的移植瘤模型,来评估ortho-hIL-2的剂量对于ortho-hIL-2Rβ+CAR-T功能的影响。
让人意外的是,大剂量(100000-250000IU/天)的ortho-hIL-2虽然能使肿瘤消退,但同时也会导致小鼠消瘦甚至死亡。
在低剂量(25000 IU/天)的ortho-hIL-2实验组中,肿瘤体积减小了,由T细胞产生的细胞因子(IFNγ,TNFα)也上升了;两周后,存活的小鼠(4/5)中检测到的T细胞数量是对照组的80倍。而且ortho-hIL-2对T细胞植活率的提升是有特异性的,只对ortho-hIL-2Rβ+T细胞有效。
那么大剂量ortho-hIL-2杀敌八百自损一千的原因是什么呢?
首先排除ortho-hIL-2本身有毒性这一可能:在没有CAR-T的小鼠中,加不同剂量的ortho-hIL-2连续14天,没有任何毒性,说明毒性是和CAR-T相关的。
因为模型本身涉及过继性转移,所以研究人员考虑了外源CAR-T导致的急性移植物抗宿主病(aGVHD)。aGVHD是T细胞通过TCR识别到来源于异体的多肽-MHC复合物后,产生的免疫排斥反应。那么这个毒性是由TCR介导的aGVHD吗?
Garcia研究组用CRISPR-Cas9敲除TCRα和β亚基之后,CAR-T的抗肿瘤能力不变,大剂量ortho-hIL-2导致的毒性也没有差别。说明毒性和TCR无关,所以也排除了aGVHD的可能性。
排除了上述两个因素之后,研究人员没有再深入探索大剂量ortho-hIL2的毒性机制尚,不过,研究人员推测这可能与快速增殖的CAR-T释放的细胞因子有关。
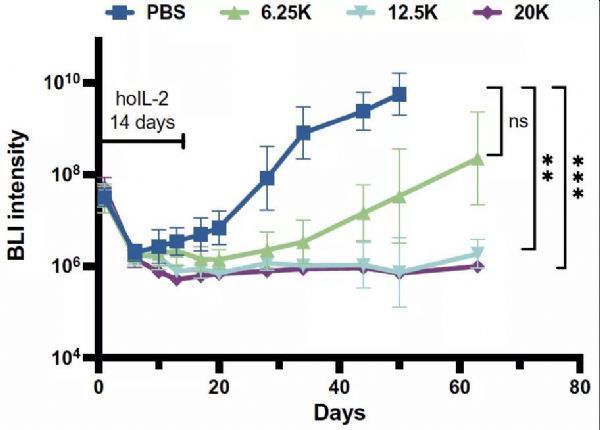
虽然ortho-hIL-2在大剂量下表现出毒性,但瑕不掩瑜,找到合适的剂量后效果还是很值得期待的。在B-ALL的小鼠移植瘤模型中,ortho-hIL-2有促进T细胞增多的效果,伴随着ortho-hIL-2剂量增大CAR-T相关的毒性也会增加。这揭示了ortho-hIL-2剂量和T细胞植活率有关。为避免大剂量ortho-hIL-2致死,Garcia研究组改用12500-20000IU/天的安全剂量,连续注射14天,成功提高了ortho-hIL-2Rβ+CAR-T细胞的抗肿瘤功效。
此外,CAR-T细胞的剂量也和抗肿瘤功效息息相关,因为有效的CAR-T治疗需要保证一定数量的CAR-T细胞在体内复制。而ortho-hIL-2能降低CAR-T对初始剂量的要求,哪怕CAR-T剂量不理想,ortho-hIL-2也可以帮忙挽救一下。在ortho-hIL-2作用下,低于有效剂量的ortho-hIL-2Rβ+CAR-T也可以成功地抑制肿瘤细胞生长。
之前探讨的都是CAR-T植入和ortho-hIL-2治疗同时进行的情况。如果是在经过CAR-T治疗的肿瘤卷土重来之后,再给予ortho-hIL-2刺激呢?
还是在接种了B-ALL肿瘤的小鼠中,用一定量的CAR-T暂时抑制肿瘤,12天后肿瘤复发时才开始20000IU/天的ortho-hIL-2治疗。ortho-hIL-2虽迟但到,依旧有效,迅速诱导CAR-T细胞增殖,引起肿瘤消退。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。