Nature子刊:于海军团队发现克服肿瘤免疫耐受,增强免疫疗效新方法
来源:生物世界 2023-06-26 14:35
中国科学院上海药物研究所于海军课题组在 Nature Communications 期刊发表了题为:Nanovesicles loaded with a TGF-β receptor 1 inhibi
肿瘤免疫治疗可激活特异性抗肿瘤免疫效应,有望实现肿瘤治愈,因而得到广泛应用。近年来,科研人员开发了多种新型免疫治疗策略,显著激活抗肿瘤免疫效应。然而,胰腺癌和三阴性乳腺癌等免疫排斥型肿瘤(immune-excluded tumors,IETs)具有免疫原性低、肿瘤内T淋巴细胞浸润不足及免疫抑制性肿瘤微环境(immunosuppressive tumor microenvironment,ITM)等特征,制约了现有治疗方案的疗效。
已有研究表明,转化生长因子β(TGF-β)信号通路是诱导肿瘤免疫耐受的关键机制之一。它可以诱导Smad2/3蛋白磷酸化,进而促进成纤维细胞基质胶原蛋白分泌并形成实体肿瘤“物理屏障”,抑制T淋巴细胞向肿瘤组织浸润,导致先天性免疫耐受。此外,干扰素γ(IFN-γ)会上调细胞程序性死亡配体1(PD-L1)等免疫检查点蛋白表达,损害T细胞功能,进而引起获得性免疫耐受。如何克服先天和获得性免疫耐受是制约IETs免疫疗效的主要挑战。
中国科学院上海药物研究所于海军课题组在 Nature Communications 期刊发表了题为:Nanovesicles loaded with a TGF-β receptor 1 inhibitor overcome immune resistance to potentiate cancer immunotherapy 的研究论文。
该研究是在于海军课题组前期开发多种肿瘤微环境响应递药系统的基础上,创新性发展了一种包载TGF-β受体1抑制剂和溴结构域蛋白4(BRD4)抑制剂JQ1的多功能纳米囊泡。该成果实现了多模态影像导航的药物协同递送和精准释放,同时克服先天性和获得性免疫耐受,有效改善免疫排斥型肿瘤(IETs)免疫疗效。研究表明,前药纳米囊泡可以同时阻断先天性和获得性免疫耐受通路,协同促进IETs的免疫治疗,有望为IETs免疫治疗提供新思路。

研究团队利用生物信息学分析发现TGFBR1在多种实体瘤中显著上调。激活的TGF-β信号通路可促进肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAF)分泌细胞外基质,形成“物理屏障”,阻碍细胞毒性T淋巴细胞(cytotoxic T lymphocytes,CTLs)向肿瘤内浸润,上调调节性T细胞(regulatory T cells,Tregs),进而导致免疫抑制微环境。为了克服TGF-β信号通路介导的免疫耐受,科研团队设计了一种包载TGF-β受体1抑制剂和光敏剂焦脱镁叶绿酸a(Pyropheophorbide-a,PPa)的酶激活纳米囊泡(ELNV)。其中,PPa螯合钆离子(gadolinium,Gd3+)后能够实现荧光、光声和磁共振多模态成像,引导671nm波长近红外光精准照射肿瘤部位。在671nm激光照射下,PPa可发挥光动力作用生成活性氧,促进药物释放并触发肿瘤细胞的免疫原性细胞死亡,提高肿瘤细胞的免疫原性、招募肿瘤浸润CTLs。
为了进一步克服IFN-γ诱导的肿瘤细胞表面PD-L1表达和获得性免疫耐受,科研人员在ELNV纳米囊泡中包裹ROS响应的BRD4抑制剂JQ1,得到共递送前药纳米囊泡(称为ELJNV)。小鼠水平的抗肿瘤药效评价结果表明,ELJNV可以有效抑制多种免疫排斥型肿瘤生长、转移和复发。该研究有望为IETs的高效免疫治疗提供重要参考。
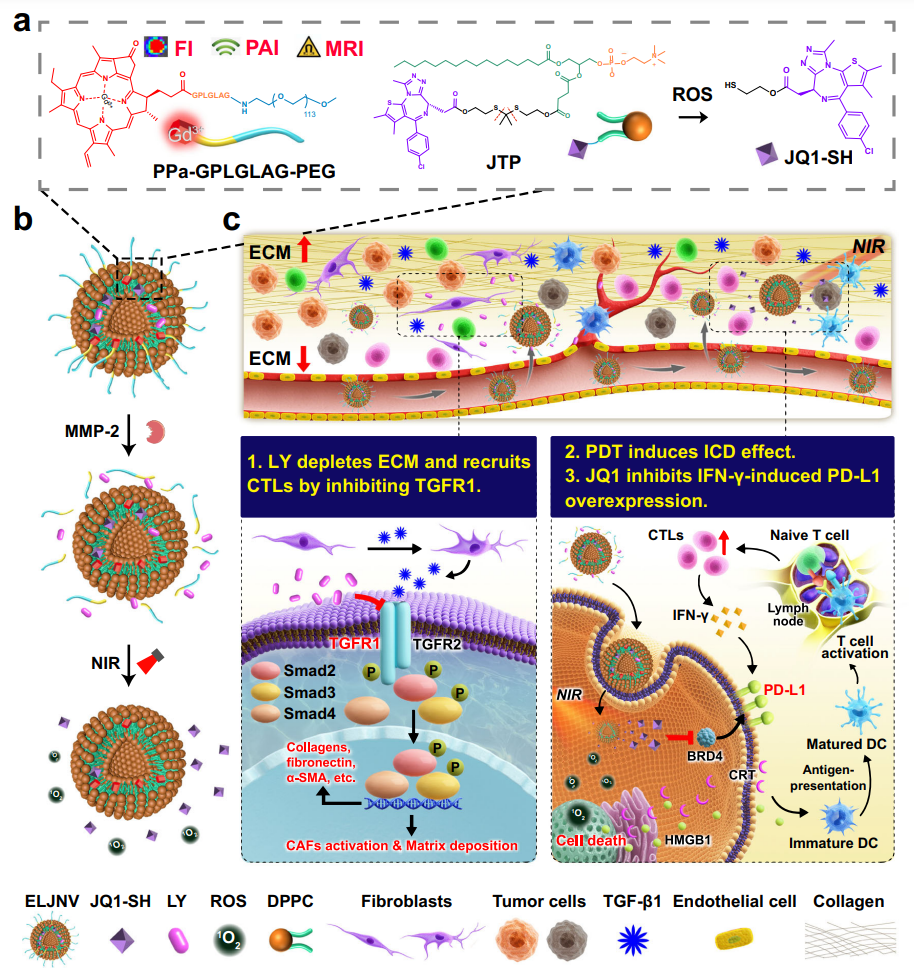
ELJNV纳米囊泡克服IETs免疫耐受、增强IETs免疫治疗的示意图
研究工作得到国家自然科学基金、上海市科学技术委员会、中国博士后科学基金、博新计划、上海市“超级博士后”计划、临港实验室开放基金等的资助。本研究中生物效应评价部分得到了张江实验室国家蛋白质科学研究(上海)设施的支持。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


