PRMT2通过组蛋白H3R8不对称二甲基化抑制SOCS3,促进右旋糖酐硫酸钠诱导的结肠炎
来源:本站原创 2021-10-25 09:31
炎症性肠病(IBD),包括溃疡性结肠炎和克罗恩病,是胃肠道内一种弛缓性炎症性疾病的集合,临床特征是反复和长期发作的腹泻和腹痛。
采用右旋糖酐硫酸钠(DSS)诱导的小鼠实验性结肠炎模型研究PRMT2在结肠炎中的作用。用慢病毒诱导的体内PRMT2沉默或过表达来研究PRMT2在结肠炎中的作用。通过western blot和表达分析了解PRMT2诱导结肠炎的表观遗传变化。PRMT2在IBD患者、小鼠炎症结肠和TNF-α刺激的小鼠肠道上皮细胞中高表达。在dss诱导的小鼠结肠炎中,PRMT2过表达加重,而敲减缓解,表明PRMT2是结肠炎发展的关键中介。
在机制上,PRMT2通过增加细胞因子信号转导抑制子3 (SOCS3)启动子区域的抑制组蛋白标记H3R8不对称甲基化(H3R8me2a)介导结肠炎。通过泛素化抑制SOCS3表达和SOCS3介导的TNF受体相关因子5
(TRAF5)降解导致TRAF5表达升高和TRAF5介导的下游NF-κB/MAPK激活。该研究表明,在结肠炎期间,PRMT2作为促炎基因的转录共激活因子。因此,靶向PRMT2可能为结肠炎提供一种新的治疗方法。
图片来源:https://pubmed.ncbi.nlm.nih.gov/34599829/
炎症性肠病(IBD),包括溃疡性结肠炎和克罗恩病,是胃肠道内一种弛缓性炎症性疾病的集合,临床特征是反复和长期发作的腹泻和腹痛。该疾病对生活质量有着深远的影响,但也被认为是大肠癌进展的主要致病危险因素,通过长期慢性肠道炎症介导。因此,迫切需要新的靶点和新的治疗方法。
尽管有大量关于实验动物和人类IBD发展的临床和实验数据,IBD的确切病因仍然难以捉摸。一般认为,遗传改变和环境因素共同作用于IBD的发病机制。随着IBD的发病,炎症的肠黏膜中TNF-α、IL-6等炎性细胞因子的分泌增强,并与疾病的严重程度相关。TNF-α的过量分泌是IBD的标志,分泌的TNF-α通过激活转录因子,如核因子-κB (NF-κB)和丝裂原活化蛋白激酶(MAPKs),刺激下游炎症介质,从而放大炎症反应。这反过来会加重粘膜损伤,并导致慢性肠道炎症。此外,最近的研究表明,表观遗传修饰,如DNA甲基化、组蛋白修饰和非编码RNA相互作用,通过调节细胞因子和紧密连接蛋白(tjp)的表达,促进了IBD的发展。了解这些IBD特异的表观遗传变化将为治疗IBD的方法提供新的见解。
组蛋白甲基化是一种常见的组蛋白修饰,涉及基因转录。蛋白质精氨酸甲基转移酶(PRMT)家族介导的精氨酸甲基化是真核生物广泛存在的翻译后修饰,在转录、细胞信号、mrna前剪接和DNA损伤信号等诸多生物学过程中发挥着关键作用。PRMT以s -腺苷-蛋氨酸(SAM)为甲基供体,将甲基转移到蛋白质精氨酸侧链的氮原子上,生成s -腺苷-l-同型半胱氨酸和甲基精氨酸。
PRMT2是PRMT家族的关键成员,包含一个高度保守的催化Ado-Met结合结构域和一个独特的Src同源结构域,可以结合富含脯氨酸基元的蛋白质。PRMT2通过甲基化组蛋白和非组蛋白在调控细胞信号和基因表达方面发挥重要作用。到目前为止,PRMT2已被证实参与乳腺癌和胶质母细胞瘤的发生,并且在CD和UC患者的肠道标本中都观察到较高的PRMT2表达。然而,PRMT2在结肠炎中的作用和机制尚不清楚。
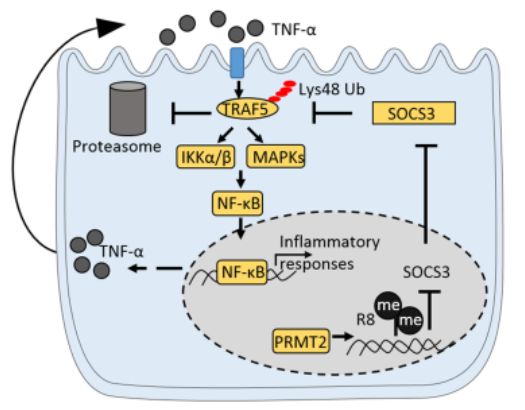
PRMT2在介导小鼠结肠炎发展中的作用和机制的图形总结
图片来源:https://pubmed.ncbi.nlm.nih.gov/34599829/
在目前的研究中,作者确定PRMT2是结肠炎的促炎介质,并提供证据表明,在体内和体外,慢病毒PRMT2过表达或敲减对结肠炎的发病和炎症反应敏感。该机制研究表明,prmt2介导的H3R8me2a甲基化可抑制SOCS3,从而抑制SOCS3介导的泛素化和TRAF5降解,进而导致TRAF5表达升高,TRAF5介导的下游NF-κB/MAPK激活。该数据为PRMT2介导的结肠炎表观遗传调控机制提供了机制见解,并可能导致通过靶向PRMT2治疗结肠炎的新治疗策略。(生物谷
Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



