非病毒载体mRNA疫苗的现状和展望
来源:生物世界 2023-12-12 13:37
该论文对于推动非病毒mRNA载体的研究和应用具有重要意义。它为科学家们提供了最新的研究进展和技术方法,为进一步优化和改进非病毒mRNA载体提供了指导。
近期,深圳大学医学部生物医学工程学院助理教授杨成彬/徐周睿与深圳市人民医院临床药师古嘉瑜等人在 Advanced Healthcare Materials 期刊发表了题为:Building a Better Silver Bullet: Current Status and Perspectives of Non-Viral Vectors for mRNA Vaccine 的综述论文。
该综述阐述了mRNA疫苗在体内的作用机制,详细调研了非病毒基因载体开发mRNA疫苗的最新进展,文章重点介绍了包括脂质纳米颗粒(LNP)、聚合物、肽和外泌体在高效mRNA递送方面的应用。
此外,文章总结了mRNA疫苗的最新临床试验进展。最后,对这些有前景的mRNA载体在临床应用中面临的挑战和未来的可能性进行了展望和讨论。本文将对从事mRNA疫苗开发的研究工作具有积极的推动作用。

2023年诺贝尔生理学或医学奖联合授予匈牙利-美国生物学家卡塔林·考里科(Katalin Karikó)和美国生物学家德鲁·韦斯曼(Drew Weissman),以表彰他们在核苷碱基修饰方面的发现,这些发现为mRNA疫苗的研制打下了坚实的理论基础。mRNA疫苗是将含有编码抗原蛋白的mRNA接种到宿主上,利用宿主细胞的表达系统合成相应的抗原,同时诱导并激活宿主对该抗原的免疫应答;当携带该抗原的病原体入侵宿主时,宿主的免疫系统会根据记忆快速做出免疫反应(图1)。
与传统疫苗相比,mRNA疫苗更加安全、高效、可快速制备、适用于个体化治疗。然而,在过去很长一段时间,由于体内递送技术上的缺陷,mRNA疫苗的临床试验进程遇到了极大的阻碍。幸运的是,近十年以来,随着材料科学与生物学的迅猛发展,新型基因载体层出不穷且mRNA的合成与修饰技术迎来重大突破,mRNA疫苗的临床应用终于看到了曙光。值得注意的是,当新型冠状病毒肺炎(COVID-19)在全球肆虐的时候,FDA紧急授权了COVID-19 mRNA疫苗的使用。mRNA疫苗的使用不仅有效地阻断了COVID-19的广泛传播,更让mRNA疫苗成为当下最热门的研究方向之一。
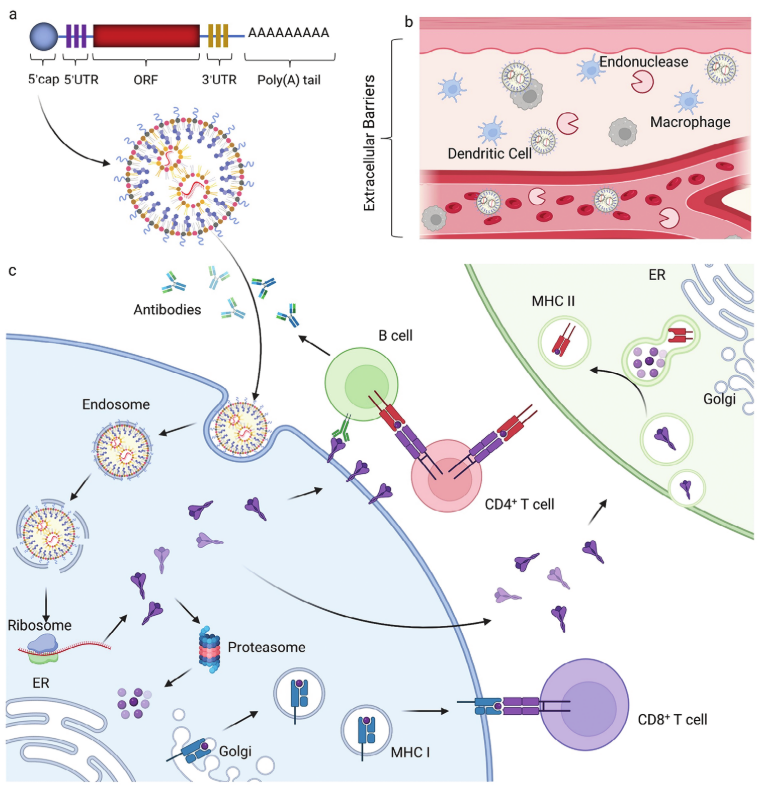
图1. mRNA疫苗的体内作用机制
mRNA疫苗的临床应用受到体内递送系统的限制。mRNA需要克服细胞外屏障和细胞内屏障才能在靶细胞的细胞质中进行翻译。虽然有一些物理方法已被证明有效,但它们通常只适用于离体水平,不适合全身施用。幸运的是,随着材料科学和分子生物学的进步,各种新型基因载体的出现有助于克服mRNA递送生理屏障,推动了mRNA的临床转化应用。目前,脂质纳米颗粒是一种被广泛接受且已应用于临床的基因非病毒载体。脂质纳米颗粒包含聚乙二醇(PEG)-脂质,胆固醇,磷脂,以及阳离子脂质(图2)。这些组分的结合一方面可以为mRNA提供一个稳定的递送环境,另外一方面可以逃避免疫监视,实现高效的递送效率。
在众多组分中,阳离子脂质具有最为重要的作用。阳离子脂质是为mRNA递送而开发的第一类脂质,它们含有胺基阳离子,携带的正电荷能够通过静电相互作用,实现对负电性mRNA的吸附和络合。但是此种正电性具有潜在的细胞毒性。可电离脂质的出现,弥补了阳离子脂质的缺陷。可电离脂质在酸性pH下带正电荷,在体内生理条件下保持电中性,避免了与血清蛋白的非特异性募集,减少细胞毒性,具有较高的血清稳定性和血液循环时间。经细胞内吞进入内体后,在低pH下可电离脂质逆转为正电性,利用“质子海绵”效应促进mRNA的内体逃逸,从而提高了转染效率。
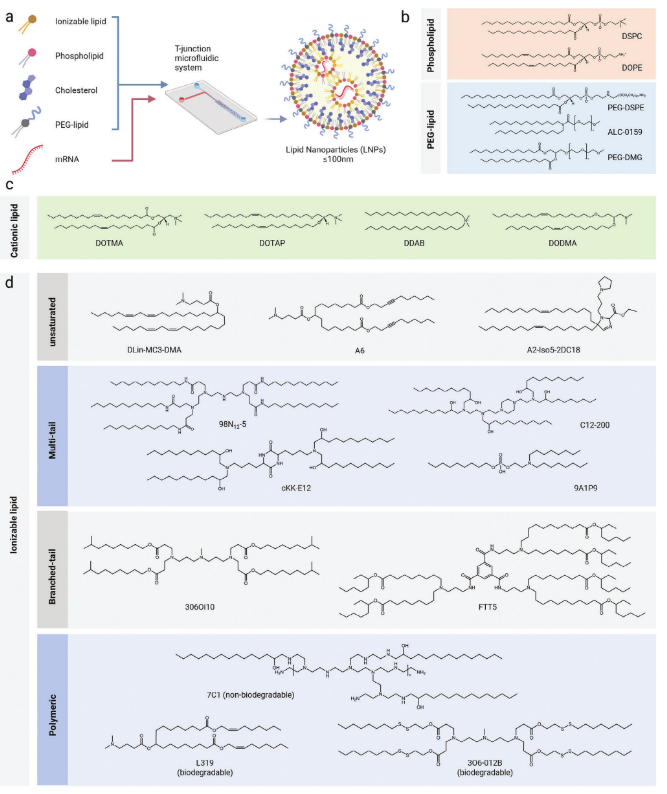
图2.基于脂质的非病毒mRNA载体
基于聚合物的mRNA疫苗是利用阳离子聚合物和核酸通过静电相互作用形成的一种纳米复合物(图3a)。阳离子聚合物将mRNA高密度压缩成纳米颗粒,将包裹mRNA在内部形成聚合物胶束,提高核酸稳定性和基因转染效率。与需要自组装、挤出和螯合的阳离子脂质相比,阳离子聚合物只需要与mRNA分子混合相对简单。此外,聚合物的不同化学结构可能为解决mRNA递送中的复杂挑战提供更多可能性。然而,基于聚合物的载体的生物相容性、细胞毒性和生物降解性需要进一步优化,以提高其安全性、有效性和体内稳定性。
除了合成的非病毒基因载体之外,天然肽也可以用作有效的基因载体以加载mRNA(图3b),这是由于一些氨基酸的正电性和两亲性有助于通过静电相互作用结合核酸。此外,氨基酸的单体单元使得基于肽的mRNA载体具有生物相容性和生物可降解性。
外泌体源自细胞天然获得的囊泡,由多泡体与质膜融合形成,大小在50- 150 nm之间,是从宿主细胞到受体细胞交换脂质、核酸和蛋白质的手段,在细胞间通讯中起着关键作用(图3c)。由于它们的细胞起源,外泌体上的表面蛋白也有助于发出“不要吃我”信号,这延长了它们的血液循环时间。
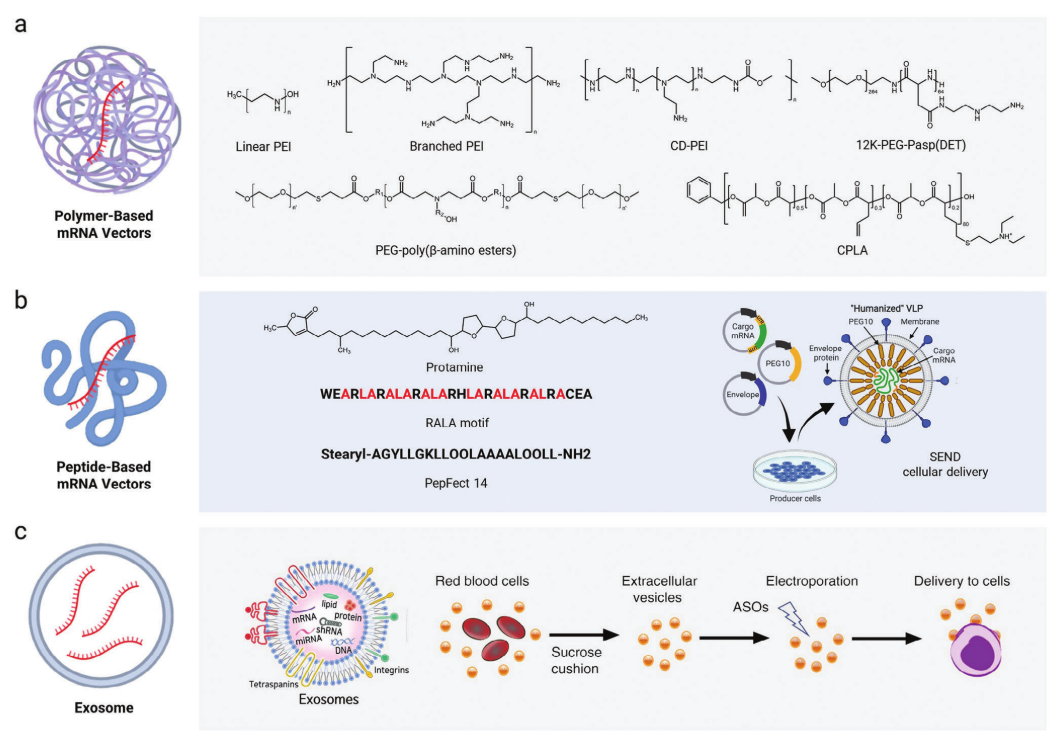
图3. 基于聚合物、肽和外泌体的非病毒mRNA载体
文章接着总结了针对传染病和癌症的mRNA疫苗临床试验进展。传统疫苗在短时间内生产足够数量的疫苗存在困难,而mRNA疫苗可以通过体外转录快速制备,无需大规模细胞培养。此外,mRNA疫苗对抗容易变异的病毒也具有优势。在SARS-COV-2、寨卡病毒、HIV、COVD-19等疾病中,mRNA疫苗在临床前及临床层面均取得了不俗的进展。然而,现阶段只有针对COVID-19的mRNA疫苗实现了临床应用(表1)。针对其他疾病的mRNA疫苗仍然需要经受更多的考验。
目前,大多数mRNA疫苗的主要给药途径是直接注射到皮肤皮下间隙或肌肉中(图4)。免疫治疗的核心思想是将癌细胞识别为抗原,进而实现针对肿瘤的治疗效果。mRNA疫苗的深入发展是肿瘤免疫治疗的重要尝试。现阶段,临床常用的mRNA癌症疫苗方法包括直接注射mRNA疫苗、 转染抗原提呈细胞和编码嵌合抗原受体(Chimeric antigen receptor,CAR)的mRNA。这些方法在应对特定肿瘤的方面有望展现出良好的治疗效果。
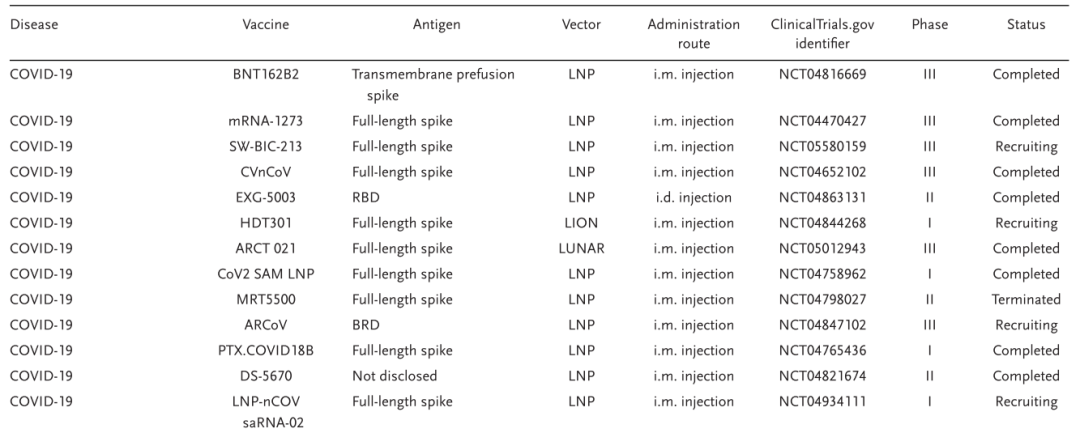
表1. 部分mRNA疫苗的临床试验
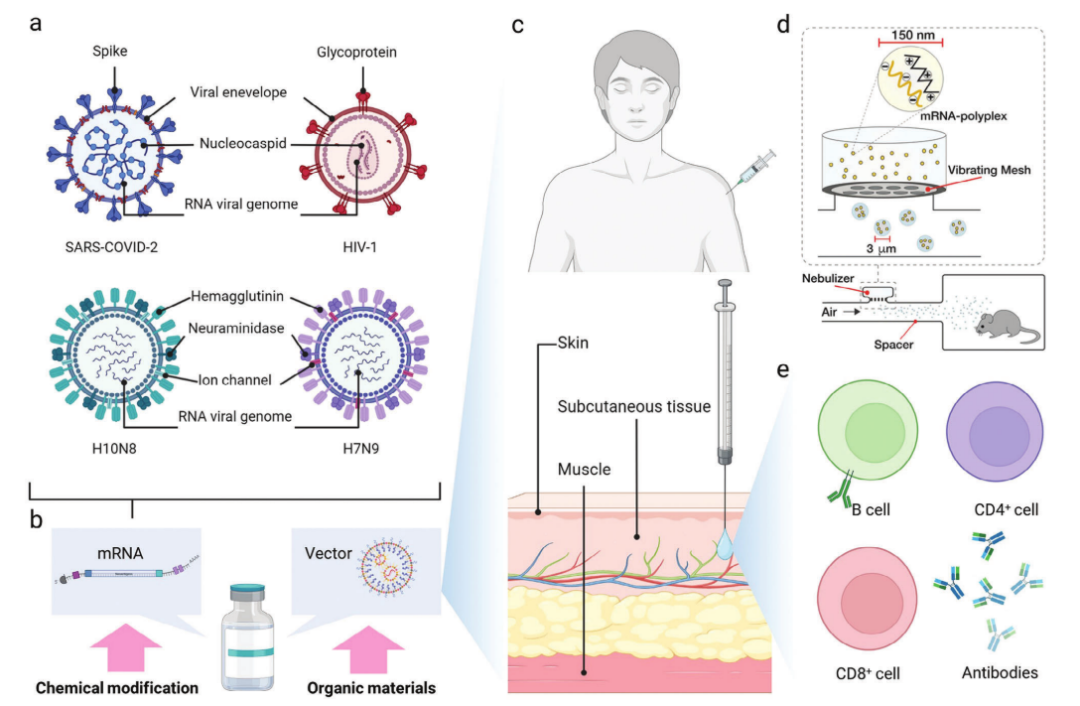
图4. 针对传染病的mRNA疫苗
针对SARS-CoV-2病毒的研究表明,mRNA疫苗在COVID-19爆发后迅速进入临床试验。其中,mRNA-1273疫苗采用可电离脂质SM-102和编码全长刺突蛋白的N1-甲基假尿苷修饰的mRNA构建复合物。动物试验和临床前研究表明,该疫苗引起了强有力的免疫应答。在第三期试验中,双倍剂量的mRNA-1273疫苗显示出94.1%的显著防护效果。此外,辉瑞和BioNTech研发的BNT 162 b2疫苗也取得了显著的预防COVID-19效果,其有效率达到95%。这些疫苗在临床使用中显示出了良好的安全性和有效性。
另外,使用合成mRNA的疫苗接种可以确保快速疫苗生产和开发,即使在观察到新流感毒株出现时也是如此。已经开发出针对不同亚型的流感病毒的mRNA疫苗,并且在动物试验中展现了有效的免疫应答。此外,通过将LNP包封的mRNA直接吸入肺中,可以最大化治疗剂的浓度并减少全身暴露,通过优化LNP的结构,可以实现吸入雾化策略用于肺部局部治疗的安全性和稳定性。
针对艾滋病病毒(HIV)的研究表明,由于HIV包膜蛋白的抗原多样性和隐藏关键包膜蛋白表位的密集“聚糖盾”,开发有效的HIV疫苗一直面临挑战,目前没有针对HIV的mRNA疫苗。然而,mRNA疫苗被认为是一种有潜力的方法,针对HIV的mRNA疫苗仍处于研究阶段。
非病毒mRNA载体的发展给医学和疫苗领域带来了巨大的希望。通过使用适当的基因载体,mRNA疫苗可以针对不同的疾病和病原体进行定制,从而提供更加个性化和精准的治疗方案。此外,非病毒mRNA载体的制备相对简单,成本较低,可以进行大规模生产,这为全球范围内的疫苗接种提供了可行的解决方案。
本文对所有非病毒mRNA载体及其在mRNA疫苗中的应用的最新进展进行了综述。虽然目前LNP在mRNA传递中占有突出地位,但我们仍然不能低估其他非病毒载体在基因传递中的作用,因为它们可能在生物医学应用中提供更多的可能性,也可能为LNP的发展带来新的思路。非病毒mRNA载体的研究和应用不仅仅局限于疫苗领域,它还具有广阔的应用前景。例如,在癌症治疗中,mRNA疫苗可以针对特定的肿瘤抗原进行定制,激活免疫系统来攻击癌细胞。此外,非病毒mRNA载体也可以用于基因治疗、遗传疾病的治疗以及其他疾病的治疗和预防。
综上所述,该论文对于推动非病毒mRNA载体的研究和应用具有重要意义。它为科学家们提供了最新的研究进展和技术方法,为进一步优化和改进非病毒mRNA载体提供了指导。
深圳大学医学部许改霞教授和悉尼大学Yong Ken-Tye教授对本文的撰写思路有重要指导,深圳大学医学部陈家杰、刘琪琪,唐世棋、张文广、深圳人民医院谢守霞、宝安妇幼保健院陈晓燕对本文的文献调研和文字撰写提供大力支持。本推文由深圳大学医学部研究生王立辰撰写。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


