研究揭示全新细胞核程序性坏死通路
来源:有机所 2024-04-12 09:27
该研究确定了非典型的由prelamin A介导的细胞核至细胞质的程序性坏死途径,以及其在prelamin A相关的早衰疾病中的重要作用。
细胞程序性坏死是一种炎性细胞死亡途径,被证明是驱动人类多种炎性疾病和退行性疾病发生发展的重要原因。在经典的程序性坏死通路中,肿瘤坏死因子TNF在特定情况下诱导受体互作蛋白激酶RIPK1活化,RIPK1与RIPK3相互作用形成坏死小体并激活RIPK3。RIPK3磷酸化MLKL,引发MLKL构象改变、寡聚化和转位到细胞质膜,并在细胞质膜上打孔以介导细胞裂解。虽然程序性坏死是一种细胞质膜裂解性死亡形式,但是细胞核仍然保持相对完整,且鲜有核膜破裂的现象。此外,控制程序性坏死发生的死亡复合物如坏死小体的组装和作用均发生在细胞质中。
近日,中国科学院上海有机化学研究所生物与化学交叉研究中心许代超课题组以Defective prelamin A processing promotes unconventional necroptosis driven by nuclear RIPK1为题,在《自然-细胞生物学》(Nature Cell Biology)上发表研究论文。该研究揭示了全新的由毒性蛋白prelamin A启动的细胞核程序性坏死通路。这种细胞核程序性坏死由核RIPK1介导,诱导细胞核坏死小体的形成,进而引起核膜的破裂和DNA向细胞质中的泄露,造成炎症反应和细胞死亡。
Prelamin A由LMNA基因编码,是核纤层蛋白lamin A的前体蛋白。在正常情况下,位于细胞核内的prelamin A经过法尼基化修饰最终被锌金属蛋白酶ZMPSTE24剪切去除C-端形成成熟的lamin A。因此,法尼基化的prelamin A是一种瞬时形态,不会在健康的细胞和组织中出现。然而,在一类罕见的人类早衰疾病中,LMNA或ZMPSTE24基因突变恰好造成法尼基化的prelamin A不能被正常剪切而在细胞中发生累积。遗传学证据表明,法尼基化prelamin A 的积累是导致早衰疾病的唯一原因,但法尼基化prelamin A造成毒性的分子机制仍不清楚。
该研究发现ZMPSTE24缺失使得细胞对于TNF刺激引起的细胞死亡更加敏感,而且这种敏感性的增加是由RIPK1/RIPK3/MLKL介导的程序性坏死引起的。此外,这种程序性坏死的发生依赖于prelamin A蛋白的累积。在机制上,定位于细胞核膜内侧的prelamin A可以发挥支架蛋白的功能,通过其C-端招募被TNF激活的RIPK1进入细胞核内,并促进核RIPK1的进一步活化,进而诱导核RIPK3的激活以及核坏死小体的形成,最终导致核MLKL的激活、核膜的破裂,以及DNA向胞质中的泄露和细胞死亡。
研究人员还发现,这种细胞核坏死途径依赖于prelamin A的法尼基化修饰。法尼基修饰是一种长链脂肪酸修饰,可以将prelamin A锚定在细胞核膜内侧。这种锚定作用有助于稳定prelamin A所形成的平台功能,从而促进细胞核内坏死小体的装配。这一发现为临床上采用法尼基转移酶抑制剂进行早衰疾病干预提供了理论依据。
由于Zmpste24-/-小鼠可表现出类似人类早衰疾病的表型,研究人员在Zmpste24-/-小鼠的多种组织中均检测到RIPK1的激活以及程序性坏死的发生。通过遗传学手段抑制小鼠体内RIPK1的激酶活性或者基因敲除RIPK3/MLKL,可以显著抑制由prelamin A引起的细胞核程序性坏死的发生,拯救Zmpste24-/-小鼠的早衰表型,延长小鼠的寿命。
该研究确定了非典型的由prelamin A介导的细胞核至细胞质的程序性坏死途径,以及其在prelamin A相关的早衰疾病中的重要作用。
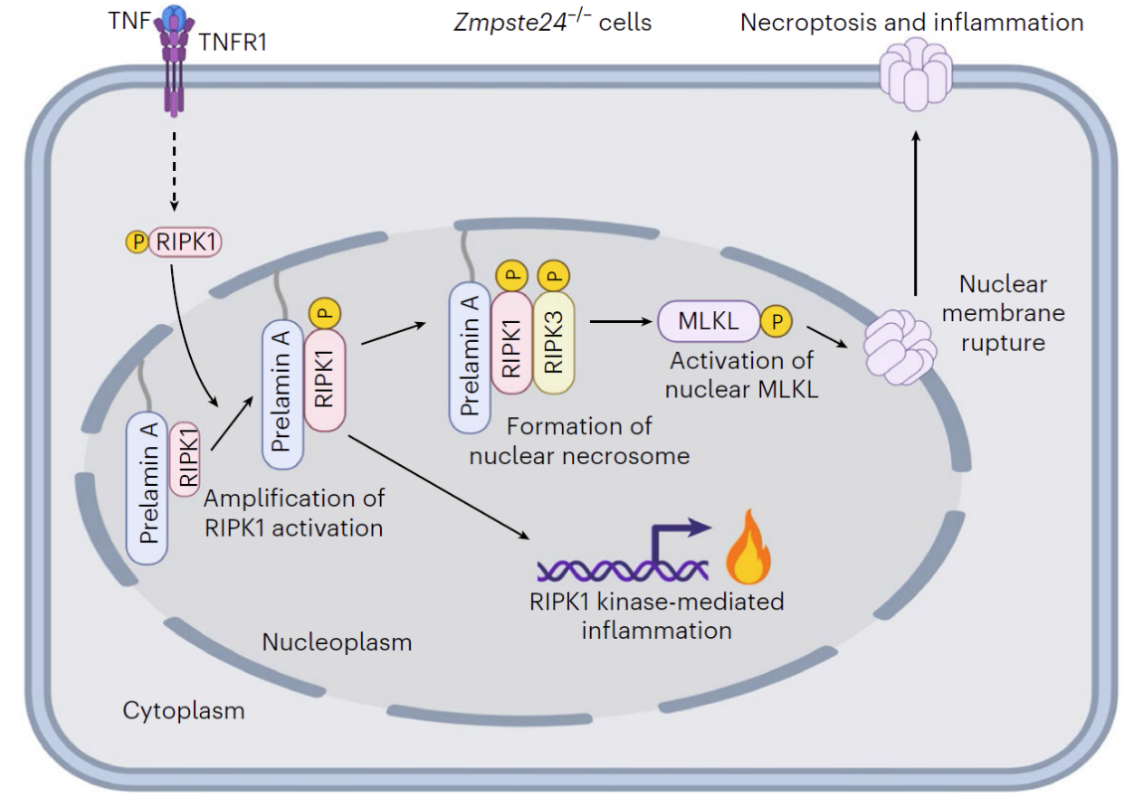
毒性蛋白prelamin A启动的由核RIPK1介导的非典型细胞核程序性坏死途径机制
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


