
曾2次遭FDA拒绝,渐冻症干细胞疗法BLA终获审查,老牌上市公司能否获「绿灯」?
来源:生辉 2023-06-14 15:18
近日,干细胞治疗上市公司 Brainstorm Cell Therapeutics Inc.(以下简称为“Brainstorm”,NASDAQ:BCLI)宣布 FDA
近日,干细胞治疗上市公司 Brainstorm Cell Therapeutics Inc.(以下简称为“Brainstorm”,NASDAQ:BCLI)宣布 FDA 将召集细胞、组织和基因疗法咨询委员会 (ADCOM) 召开会议审查在研候选管线 NurOwn 的生物制品许可申请(BLA)。

这次咨询会似乎也让 Brainstorm 对核心管线 NurOwn 重拾希望。去年 11 月,该公司收到了 FDA 的立卷审查拒收( Refusal to File,RTF) 函。在与 FDA 进行了 A 类会议和讨论之后,Brainstorm 通过对该 RTF 提交抗议程序争取到了重新审查的机会,并要求 FDA 在最短时间内完成审查流程。
该公司的联合首席执行官 Stacy Lindborg 博士指出,我们对 NurOwn 仍然充满信心,并相信试验数据能够支持监管机构批准。与绝大多数 ALS 临床研究类似,我们的临床试验产生了复杂的结果,值得科学家、ALS 专家、FDA 审查员和患者进行全面详细的审查。
“一种极具前景的细胞治疗方案”
Brainstorm 是一家成立近 23 年的干细胞疗法公司,位于华盛顿州,瞄准了神经退行性疾病。根据官网的介绍,Brainstorm 的研发重点是用于治疗神经退行性疾病的自体细胞疗法。该公司已经开发出了一种创新型且经过验证的自体细胞技术平台 NurOwn®,并基于这一技术平台开发出了称之为 NurOwn 的治疗方法。
这种方法的相关专利技术源自以色列特拉维夫大学 Dani Offen 博士和已故医学博士 Eldad Melamed 实验室的研究成果,由 Brainstorm 和以色列特拉维夫大学共同开发推进。Dani Offen 是特拉维夫大学人类遗传学和生物化学系神经病学实验室负责人,研究方向主要是专注于开发基于细胞和基因的神经退行性疾病疗法,包括基于间充质干细胞、外泌体和多肽等技术平台将治疗性药物递送到中枢神经系统。他是该公司的科学创始人,还曾在 Brainstorm 担任过首席科学家和首席科学顾问。

▲图 | Dani Offen 博士(来源:特拉维夫大学官网)
NurOwn 方法由从患者骨髓中提取的间充质干细胞(MSC)制成。具体而言,该公司对这些通过专有技术采集的间充质干细胞进行工程改造和分化,使其能够分泌有助于保护和促进神经元生长的神经营养因子(NTF),这些经过改造的细胞就称为 MSC-NTF 细胞(注:MSC-NTF 细胞并未经基因改造)。然后将这些经修饰的细胞通过椎管注射的方式移植到患者体内,从而减缓或阻止神经退行性疾病。
Brainstorm 方面称,自家的自体 MSC-NTF 细胞通过靶向神经退行性疾病中重要的疾病通路治疗疾病,代表了一种非常具有前景的创新型细胞治疗方案,也有望成为治疗神经退行性疾病的潜在变革性方法。这种方法可以有效将多种 NTF 和免疫调节细胞因子直接递送至损伤部位,以引发所需的生物学效应,并最终减缓或稳定疾病进展。
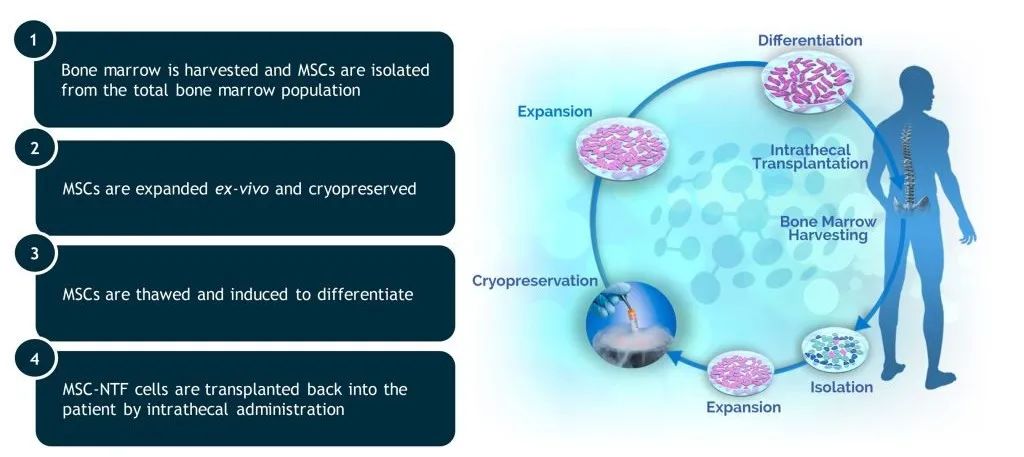
长久以来,Brainstorm 一直在推进 NurOwn 用于多种神经退行性疾病的治疗,包括 ALS、多发性硬化症(MS)、阿尔茨海默氏病、帕金森病、亨廷顿病以及自闭症谱系障碍等等。现阶段,该公司已经开发出了 8 条干细胞治疗管线。其中,NurOwn 用于治疗 ALS 的治疗管线进展最快,已经取得临床 III 期数据;用于 MS 正处于临床 II 期阶段;NurOwn 用于帕金森病、亨廷顿病以及自闭症谱系障碍进展较慢,正在临床前探索新研究阶段。
曾两次遭 FDA 拒绝
正如 Brainstorm 对于 NurOwn 的期待一样,NurOwn 用于 ALS 疾病治疗在早期的临床试验中表现积极的效果。
2014 年,FDA 授予了 NurOwn 用于治疗 ALS 的快速通道认定。当时,该公司正在推进 NurOwn 在 ALS 患者中的一项随机、双盲、安慰剂对照的 II 期临床试验;2016 年,这家公司表示,已经完成了临床 II 期试验中 NurOwn在 48 名受试者中的安全性测试,这种干细胞疗法展示出了良好的安全性和耐受性,还具有长达 24 周的显著临床受益效果。
这些结果鼓励该公司将其推入后期临床试验,并于次年开始了一项规模更大的试验。2017 年,研究人员开启了 III 期临床试验,这是一项多中心、安慰剂对照、随机、双盲的 III 期试验,旨在评估 NurOwn 在 189 名 ALS 患者中的安全性和有效性。并于 2018 年 8 月通过了药物安全监测委员会的审查,经审查,NurOwn 被认为无明显的安全性问题。

数据发布之后,Brainstorm 方面认为尽管试验失败了,但已经收集到足够多的积极数据证实该候选药获批。然而,这并不能使 FDA 信服。在更大规模的研究数据公布后不久,2021 年 3 月,FDA 通过一份公开信拒绝了 NurOwn 的申请,并告诉该公司试验数据“根本没有统计意义”,不足以支持批准申请。
第一次遭到 FDA 拒绝后,BrainStorm 决定进一步分析数据,并表示 III 期试验中也释放了一个较好的信号,NurOwn 在病情较轻的患者组中产生了具有临床意义的疗效,会使病情较轻的患者受益。通过分析和调整,2022 年 8 月重新递交了 NurOwn 用于 ALS 的 BLA 批件。
此举遭到了 FDA 工作人员的反对,FDA 方面做出了不审查该 BLA 的决定并向 Brainstorm 发出了立卷审查拒收函。当时,FDA 称此申请存在重大缺陷。这意味着 FDA 在还没有审查该公司递交的 BLA 时,就否决了这款干细胞治疗产品。于是,Brainstorm 与 FDA 进行了 A 类会议,讨论对递交的 BLA 发出立卷审查拒收函的内容。
后续,Brainstorm 方面决定奋力一搏,通过 File Over Protest (提交抗议)途径审查 BLA,这是最快的一条审批路径。提交抗议是 FDA 法规允许的程序性举措,允许公司在与监管机构就 NDA 提交的可接受性存在分歧时提交 NDA 并进行审查。FDA 将必须在 12 月 8 日之前发布批准审查决定。
BrainStorm 的总裁兼首席执行官 Chaim Lebovits 表示:“我们对 FDA 去年在 ALS 领域表现出的监管灵活性倍感鼓舞,尤其是在 NurOwn 方面,我们相信召开咨询委员会会议对患者有益。” 对于 BrainStorm 而言,该候选管线能否获批一定程度上也会对公司的技术平台价值有一定的影响。
提出抗议后,该公司的股票交易价格接近 3 美元/股,这一交易价格是提出抗议途径前的 2 倍多。截止发稿,Brainstorm 的市值为 1.12 亿美元。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


