核酸药物: Rab18是GalNAc偶联siRNA诱导Hep3B细胞沉默的关键调控因子
来源:生物谷原创 2022-06-01 10:02
小干扰RNA(SiRNAs)是一种通过RNA干扰(RNAi)途径特异性降解靶基因mRNA的短小(20-25bp)双链RNA分子。
小干扰RNA(SiRNAs)是一种通过RNA干扰(RNAi)途径特异性降解靶基因mRNA的短小(20-25bp)双链RNA分子。尽管siRNA疗法具有巨大的治疗潜力,但由于将大的、带高负电荷的核酸输送到细胞内所带来的挑战,siRNA疗法受到了限制。
结合N-乙酰半乳糖胺(GalNAc)已被证明是一种成功的肝细胞靶向siRNA治疗策略,并推动了利用受体介导的siRNA摄取将siRNA靶向输送到其他类型细胞的研究。在肝细胞上,GalNAc与高表达的清道夫受体ASGPR(无唾液酸糖蛋白受体)结合,通过网状蛋白包被的内体将siRNA运送到质膜上。
人ASGPR是由两个亚基组成的异源低聚物:主要的ASGR1(去唾液酸糖蛋白受体1)亚基和次要的ASGR2(去唾液酸糖蛋白受体2)亚基,其中ASGR1是高效传递GalNAc结合的siRNA的关键。虽然GalNAc结合改善了siRNA的传递,但它仍然是一个低效的过程。

图片来源: https://doi.org/10.1016/j.omtn.2022.04.003
近日,来自美国安进全球研究部基因组研究人员在Molecular Therapy: Nucleic Acids杂志上发表了题为“RAB18 is a key regulator of GalNAc-conjugated siRNA-induced silencing in Hep3B cells”的文章,该研究证实了Rab18是GalNAc偶联siRNA诱导Hep3B细胞沉默的关键调控因子。
小干扰RNA(SiRNA)疗法近年来发展迅速,尽管存在与递送大的、高电荷的核酸相关的挑战。通过将siRNA与N-乙酰半乳糖胺(GalNAc)结合在一起,在皮下注射后提供持久的肝细胞基因敲除,siRNA治疗药物已经被建立到肝脏。
GalNAc结合肝细胞上高表达的去唾液酸糖蛋白受体(ASGPR),并利用这种清道夫受体通过内吞作用将siRNA运送到质膜上。然而,siRNA需要进入细胞质中的RNA诱导沉默复合体(RISC)才能提供有效的基因敲除,而且整个siRNA传递过程非常低效,可能是因为siRNA的内体逃逸、细胞内转运和稳定性所需的步骤。
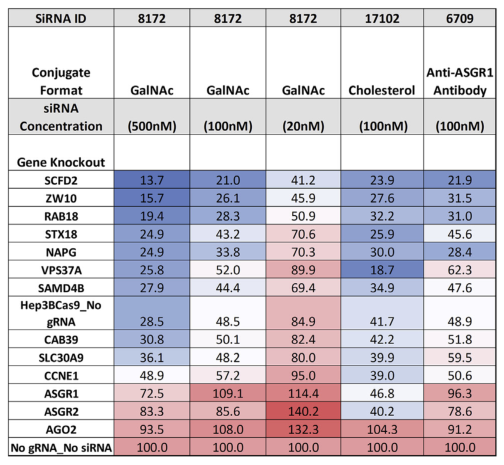
为了揭示限制siRNA治疗药物传递的细胞因素,研究者在人肝细胞癌细胞系Hep3B中以GalNAc结合的针对HPRT1基因的siRNA传递为基础,进行了全基因组池基因敲除筛选。初级全基因组池基因敲除筛选确定了候选基因,当被敲除时,显着增强了在Hep3B细胞中的siRNA效率。
后续研究表明,敲除Rab18可以提高GalNAc、胆固醇或抗体传递的siRNA的效率,但不能提高脂质体转染法传递的siRNA的效率,这表明Rab18在siRNA传递和细胞内转运中发挥了作用。
大规模全基因组池CRISPR-基因敲除筛选实验及候选基因验证
图片来源: https://doi.org/10.1016/j.omtn.2022.04.003
在本研究中,研究者报告了使用全基因组池CRISPR-Cas9筛选的单个基因(Rab18)的鉴定,当敲除该基因时,可以在Hep3B细胞中将siRNA介导的基因沉默增强至少20倍(IC50)。鉴于目前人们对使用siRNA作为一种治疗方式的兴趣,以及对改进给药方法的需要,确定这一关键调节因子可能有助于开发未来的药理学策略以提高siRNA的疗效。
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


