ACS Nano:张志文/李亚平/张翱合作开发智能仿生递药系统,改善肿瘤免疫治疗
来源:生物世界 2022-12-21 11:06
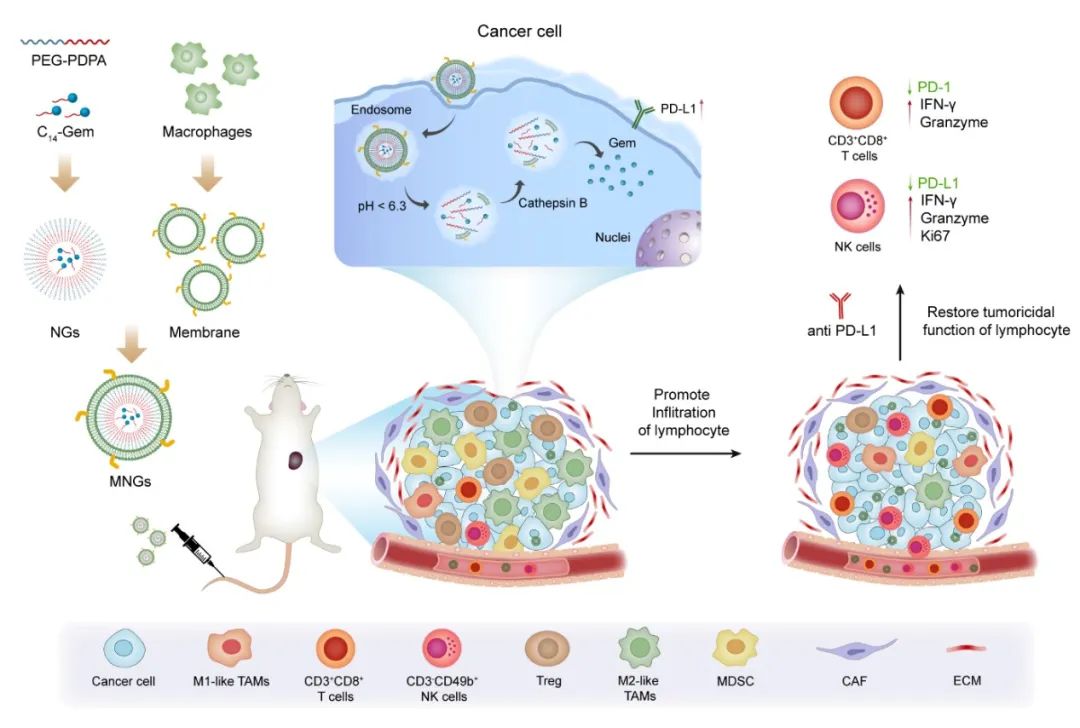
该研究设计合成了酸敏感两亲性聚合物(PEG-PDPA)以及酶敏感吉西他滨前药(C14-Gem)并制备成胶束;通过巨噬细胞膜的覆盖制备成MNGs。
免疫检查点阻断是肿瘤治疗领域的革命性进展,但耐药导致仅有一小部分癌症患者对该疗法有响应。在某些肿瘤中,癌细胞可阻止淋巴细胞的浸润,且大部分浸润性淋巴细胞功能为耗竭状态。因此,如何促进淋巴细胞的浸润以及扭转淋巴细胞杀伤功能成为肿瘤免疫检查点阻断治疗的关键问题。
复旦大学药学院张志文团队、中国科学院上海药物研究所李亚平团队、上海交通大学药学院张翱团队合作,在 ACS Nano 期刊发表了题为:Macrophage Membrane-Coated Nano-Gemcitabine Promotes Lymphocyte Infiltration and Synergizes AntiPD-L1 to Restore the Tumoricidal Function 的研究论文。
该研究设计并构建了一种负载吉西他滨前药的智能仿生递药系统(MNGs),用于提高瘤内淋巴细胞的浸润并进一步提高免疫检查点阻断剂的抗肿瘤效果。

该研究设计合成了酸敏感两亲性聚合物(PEG-PDPA)以及酶敏感吉西他滨前药(C14-Gem)并制备成胶束;通过巨噬细胞膜的覆盖制备成MNGs。由于巨噬细胞膜的仿生特性,MNGs能够在肿瘤部位蓄积并渗透进入肿瘤深部,提高肿瘤内部淋巴细胞的浸润以及免疫检查点PD-L1表达,协同PD-L1单抗重新激活淋巴细胞的抗肿瘤杀伤功能。
研究结果表明,与MNGs单药治疗组相比,MNGs+PD-L1单抗联合治疗组可使耗竭状态的CD3+CD8+T细胞和自然杀伤细胞分别减少31.77%和30.63%,而干扰素-γ阳性亚型分别增加2.83倍和3.17倍。在多种肿瘤模型中产生可观的治疗效果。因此,MNGs为促进淋巴细胞的浸润和协同PD-L1单抗恢复淋巴细胞肿瘤杀伤能力提供了一种新思路。
复旦大学张志文研究员、上海药物所李亚平研究员及上海交通大学张翱教授为论文共同通讯作者,上海药物所博士后李杰、上海药物所-复旦大学联合培养研究生吴瑶为论文第一作者。该论文得到国家重点研发计划、国家自然科学基金等项目资助。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


