Cell:夏时雨等开发合成蛋白回路,可编程控制细胞凋亡和焦亡
来源:生物世界 2024-04-29 10:32
哺乳动物系统(包括人类)使用不同的细胞死亡程序来消除有害细胞并形成免疫力。细胞凋亡(Apoptosis)在免疫上是“冷的”,相比之下,细胞焦亡(Pyroptosis)在免疫学上是“热的”。
加州理工大学Michael Elowitz教授、夏时雨博士等在国际顶尖学术期刊 Cell 上发表了题为:Synthetic protein circuits for programmable control of mammalian cell death 的研究论文。
在这项研究中,研究团队开发了一种合成蛋白水平细胞死亡回路——Synpoptosis回路,该回路通过水解调控细胞死亡执行蛋白,从而控制哺乳动物细胞凋亡和细胞焦亡。此外,该回路可以使用病毒样颗粒(VLP)递送并在细胞间传递,这为工程合成杀伤细胞提供了基础,这些杀伤细胞在靶细胞中诱导所需的死亡程序而不会自我毁灭。总之,这些结果为哺乳动物细胞死亡的可编程控制奠定了基础。

哺乳动物系统(包括人类)使用不同的细胞死亡程序来消除有害细胞并形成免疫力。细胞凋亡(Apoptosis)在免疫上是“冷的”,相比之下,细胞焦亡(Pyroptosis)在免疫学上是“热的”,涉及损伤相关分子模式(DAMP)的大量释放。
细胞凋亡和细胞焦亡各有优势,具体取决于免疫环境。细胞焦亡的免疫刺激性可促进细胞杀伤。例如,在15%的少数细胞中诱导细胞焦亡足以通过增强抗肿瘤免疫来清除整个肿瘤。与此一致的是,细胞焦亡的执行者gasdermin(GSDM)蛋白家族的表达与癌症患者的生存呈正相关,并且细胞毒性淋巴细胞(CTL)上调癌细胞中GSDM的表达。为了逃逸细胞焦亡,癌细胞产生失活型GSDM突变,沉默GSDM的表达,并表达非焦亡型GSDM变异体。但如果过度触发细胞焦亡,则可导致病理性炎症。因此,可控地诱导细胞凋亡或细胞焦亡并调节它们的相对频率是可取的。
现有的细胞杀伤方法不能完全指导细胞死亡方式。细胞毒性药物通常仅限于触发冷肿瘤的细胞凋亡。CAR-T细胞可以有效靶向表达单一抗原或多种抗原的细胞。然而,为了杀伤靶细胞,CAR-T细胞通常使用颗粒酶,而颗粒酶可能会诱导细胞凋亡或焦亡。也有研究尝试过不依赖颗粒酶的方法,包括工程化TRAIL-呈递细胞和调节caspases、BID或BAX的合成回路。然而,这些方法同样局限于诱导细胞凋亡。
为了实现对细胞死亡的定制控制,我们需要一组具有以下特征的合成回路:
第一,这些回路应该允许细胞凋亡和细胞焦亡的激活和抑制。
第二,它们应该在各种细胞环境中引导细胞死亡模式。
第三,它们应该允许对多个输入信号进行整合和计算。
第四,它们应该能够选择性地杀死靶细胞。
第五,它们应该支持细胞间的传播,从而有可能改造合成杀伤细胞,利用设计好的死亡程序消除其他细胞。
在这项研究中,研究团队提出了具有上述特征的合成蛋白水平细胞死亡回路——Synpoptosis回路。为了设计这些回路,研究团队从利用调节蛋白水解以及蛋白水平的笼合和降解机制的自然细胞死亡途径中获得了灵感。Synpoptosis回路为理性设计、可编程控制哺乳动物细胞死亡提供了基础。
具体来说,细胞凋亡相关的半胱天冬酶(caspase)会促进细胞凋亡,同时它还能通过裂解细胞焦亡蛋白GSDM在细胞焦亡中打孔。烟草蚀纹病毒蛋白酶(TEVP)可以激活修饰的caspase-3,为了实现更复杂的下游细胞凋亡控制功能,研究团队设计了额外的caspase-3变体,可以通过TEVP裂解调节其细胞凋亡活性。接下来,研究团队设计对细胞焦亡的调控,将TEVP、烟草叶脉斑状病毒蛋白酶(TVMVP)和丙型肝炎病毒蛋白酶(HCVP)的切割位点插入到3种哺乳动物GSDM的N端和C端结构域之间的连接区域,在同源蛋白酶存在的情况下,每个工程化GSDM都有效触发细胞焦亡,研究团队在后续实验中聚焦于GSDMA,与caspase-3一样,研究团队设计了额外的GSDM变体,可以对细胞焦亡进行正向和负向控制。这种合成蛋白回路可以双向调控细胞凋亡和细胞焦亡。接下来,研究团队使用该蛋白回路让易凋亡细胞焦亡,让易焦亡细胞凋亡,从而在各种细胞环境中的细胞死亡模式,调整细胞凋亡和细胞焦亡之间的比率。
此外,该蛋白回路可以使用病毒样颗粒(VLP)递送并在细胞间传递,这为工程合成杀伤细胞提供了基础,这些杀伤细胞在靶细胞中诱导所需的死亡程序而不会自我毁灭。总之,这些结果为哺乳动物细胞死亡的可编程控制奠定了基础。
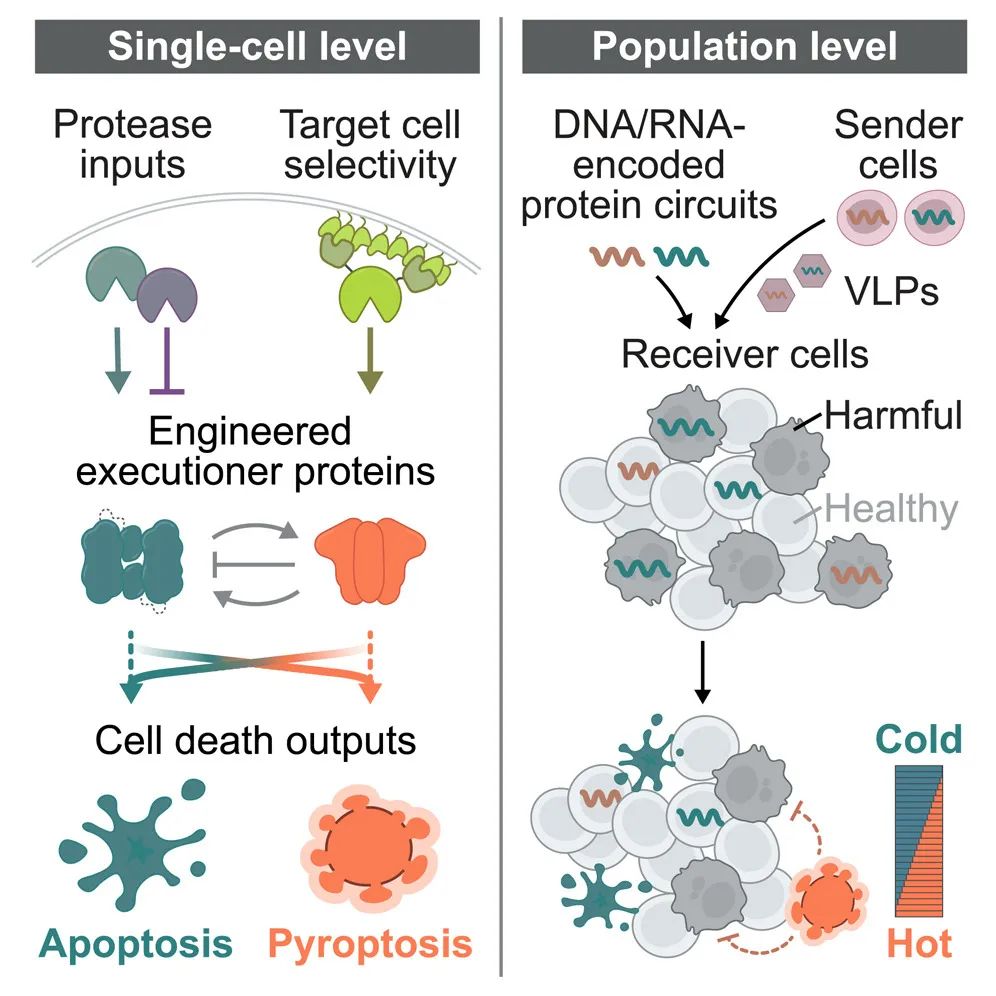
哺乳动物系统根据细胞状态和期望的免疫结果触发特定的细胞死亡程序。同样,如果能够以正确的方式杀死正确的细胞,许多治疗难题都可以得到解决。例如,Synpoptosis回路可被递送至肿瘤,以安全增强抗肿瘤免疫的方式有条件地诱导癌细胞死亡。该回路还可用于消除发挥其他有害作用的细胞,例如衰老细胞、纤维化细胞、自身免疫细胞和受感染细胞,并可在适当的免疫刺激下做到这一点。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


