Nature:新研究破解在人类慢性肝病期间肝脏再生机制
来源:生物谷原创 2024-05-28 11:23
这项新的研究表明,人体器官即使在长期患病和反复受伤后也能再生。然而,这一过程是有风险的,也可能出错。控制细胞可塑性的获得至关重要。
在一项新的研究中,来自柏林健康研究所和剑桥大学等研究机构的研究人员发现了慢性肝病期间驱动肝脏再生的机制。这种再生过程能让肝脏在慢性损伤时进行自我修复,但也可能导致肝脏向癌症方向发展。他们首先对从进行性代谢功能障碍相关性脂肪性肝病(metabolic dysfunction-associated steatotic liver disease, MASLD)患者身上获得的许多活检组织进行了单细胞分析,从而证明了这一点。他们还在实验室中使用体外培养的类器官对在体内获得的结果进行了验证。相关研究结果于2024年5月22日在线发表在Nature期刊上,论文标题为“Acquisition of epithelial plasticity in human chronic liver disease”。

论文共同通讯作者、柏林健康研究所干细胞再生疗法教授Ludovic Vallier通过培养微型肝脏(即所谓的类器官)来研究肝脏疾病是如何形成的,以及如何治疗或预防这些疾病。他的长期目标是将肝脏类器官用作针对肝衰竭患者的细胞疗法。
MASLD及其慢性形式——代谢功能障碍相关性脂肪性肝炎(Metabolic dysfunction-associated steatohepatitis, MASH)是肝病的主要病因。据估计,20%~40% 的人患有这种疾病的良性形式,但目前约有 1.15 亿人患有这种疾病的慢性形式。
尽管最近取得了一些进展,但针对晚期MASH的唯一治疗方法是肝移植,这涉及到大量的免疫抑制治疗,由于缺乏器官捐献者,只有有限的患者能从这种方法中受益。
因此,作为开放靶点项目的一部分,来自Vallier团队的Chris Gribben博士和Vasileios Galanakis博士与剑桥大学的Irina Mohorianu博士和Michael Allison博士合作,将注意力转向了这一重大医疗挑战的研究。
Vallier说,“我们惊讶地发现,人们对这种人类疾病进展过程中发生的机制知之甚少。这是因为研究一种需要数十年才能完全发展的疾病非常具有挑战性。进行广泛纵向研究所需的技术直到最近才出现。”
慢性损伤从根本上改变了肝脏的结构
这些作者从阿登布鲁克医院MASLD服务部门接受诊断测试的患者身上采集了小块肝脏(活检组织),并进行了单细胞分析,以确定内在的机制。这些活检组织样本采集自大量处于不同疾病阶段的患者,从而首次绘制出了MASLD在人类中的进展图。
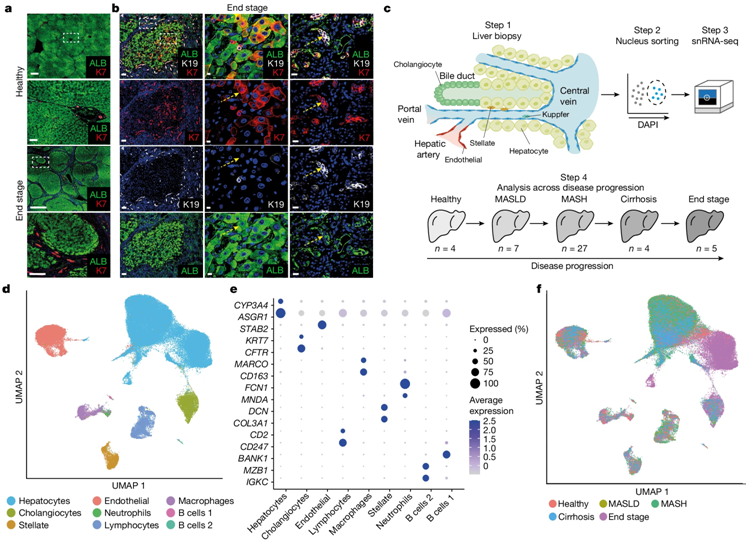
图片来自Nature, 2024, doi:10.1038/s41586-024-07465-2
他们发现了一个有趣的机制: 慢性肝损伤会严重破坏肝脏结构,尤其是胆道系统(biliary tree)的组织结构。这种结构重组与一种叫做转分化(transdifferentiation)的再生过程有关。
Vallier报告说,“我们知道,疾病进展会诱发胆管上皮细胞(cholangiocyte)增殖,而胆管上皮细胞是构成胆道系统的主要细胞类型。但是,我们没有想到这种增殖是有组织的,而且会产生如此复杂的网络,从而对肝脏的结构产生强烈的干扰。”
疾病进展与再生迹象有关
Vallier解释说,“当然,我们如今想知道,这一过程是肝脏试图自我修复的迹象,还是损伤正在进展的迹象。为此,我们进行了详细的单细胞分析,观察到胆管上皮细胞似乎转分化为肝实质细胞(肝脏的主要功能细胞类型)。因此,这种器官会拼命替换这些在疾病期间死亡的功能细胞。”
Vallier说,“令人兴奋的问题是揭示这一再生过程背后的潜在机制:我们能否找出控制再生的候选因子?我们很幸运能与Irina Mohorianu博士领导的一个核心生物信息小组密切合作。我们共同确定了一系列在胆管上皮细胞和肝实质细胞之间的转分化过程中发生上调的因子。随后,我们在从其他患者身上收集的组织中对这些因子进行了验证。特别有趣的是,我们发现胰岛素信号传导可能起主要作用,从而为未来的治疗开发提供了一个有趣的途径。”
下一步,这些作者利用来自进行性MASLD患者的胆管上皮细胞构建出类器官。这些微型器官几乎可以在体外无限生长,同时保持与疾病建模相关的功能。
尤其令人感兴趣的是,他们发现这些类器官还能在体外转分化为肝实质细胞样细胞(hepatocyte-like-cell)。可以通过抑制或增强胰岛素信号通路来阻止或促进这一过程。此外,在患者体内发现的其他因素在体外也存在,这证实了类器官与在培养皿中研究再生机制的相关性。Vallier说,“因此,我们能够证明,在很长一段时间内,人类体内发生的分子机制可以在体外研究。”他们的研究结果还表明了器官再生的一个更重要的方面。
事实上,大多数转分化事件都发生在这种疾病的最后阶段,此时肝脏受损严重。这种再生过程与疾病进展有关,似乎不是由损伤直接诱发的。
此外,晚期肝病与肝癌密切相关,而一些似乎在体内和体外驱动转分化的因子在肝脏肿瘤中也高度表达。因此,这些作者怀疑,肝癌可能源于再生过程出了问题。
事实上,慢性损伤和病变的微环境会对细胞造成巨大压力,从而使细胞变得“可塑”,进而能够发生转分化。然而,这种可塑性的获得如果走得太远,就会变得不正常。
再生与肿瘤发生之间的平衡至关重要
这项新的研究表明,人体器官即使在长期患病和反复受伤后也能再生。然而,这一过程是有风险的,也可能出错。控制细胞可塑性的获得至关重要。这些发现使我们对慢性肝病病理生理学的基本认识发生了重大转变。这包括发现控制疾病进展与组织修复之间平衡的新途径,以及确定用于诊断和预后的新型生物标志物。
Vallier报告说,“我们当然对这些成果感到兴奋,因为我们相信,我们已经找到了一种方法,可以开发出不仅仅着眼于限制疾病进展,而是旨在促进组织修复的新疗法。我们知道,在这些知识对临床产生影响之前,我们还需要做更多的研究工作,但这是至关重要的第一步。如今,我们可以集中精力开发新的疗法,包括基于细胞的方法,最终帮助患者。这就是我们的目标。”(生物谷Bioon.com)
参考资料:
Christopher Gribben et al. Acquisition of epithelial plasticity in human chronic liver disease. Nature, 2024, doi:10.1038/s41586-024-07465-2.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


