Mol Ther | 吴皓/杨辉合作研发新型基因编辑工具成功实现遗传性耳聋DFNB9基因治疗
来源:生物探索 2023-12-19 09:41
本研究通过单个AAV载体携带CRISPR/Cas13 RNA单碱基编辑系统emxABE,实现了OTOF Q829X遗传性耳聋小鼠安全有效的递送及更高的治疗效率
上海交通大学医学院附属第九人民医院吴皓教授团队与辉大生物杨辉教授课题组合作在Molecular Therapy 发表题为“RNA base editing therapy cures hearing loss induced by OTOF gene mutation”的研究论文,该研究首次采用单个AAV为载体携带自主开发的CRISPR/Cas13 RNA单碱基编辑工具(emxABE)在人源化OTOF Q829X点突变的遗传性聋小鼠模型中实现了mRNA中突变位点的高效精准修复,并且证实该编辑方法安全、有效,为OTOF点突变提供了一种优选的临床治疗策略,也是迄今唯一使用 RNA 单碱基编辑策略来治疗遗传性听力损失的药物。

经过研究团队前期的不断优化,获得蛋白尺寸小且各方面综合性能最佳的mini-dCas13X.1,随后将其与 RNA 编辑酶腺苷脱氨酶 (adenosine deaminase action RNA,ADAR) 联用,获得RNA单碱基编辑工具emxABE,可以实现A到I高效碱基编辑功能。作为目前已知报道的尺寸最小的一类RNA单碱基编辑工具,emxABE很好地克服了AAV病毒载体递送基因编辑工具的尺寸限制障碍。CRISPR-Cas13系统可在gRNA向导下靶向RNA,与传统的RNA干扰技术相比,CRISPR-Cas13系统具有更高的敲低效率和特异性; 与Cas9介导的CRISPR DNA编辑技术相比,CRISPR-Cas13系统不会对基因组造成永久性改变,具有可逆性,相对来说更为安全,因此在疾病治疗上具有独特的先天优势。
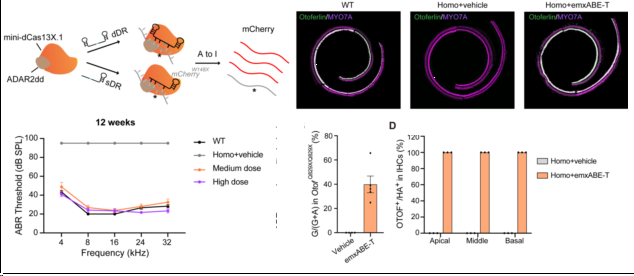
图1 AAV-emxABE实现OTOF Q829X小鼠Otoferlin蛋白正常表达和听力的恢复
研究团队在人源化的Otof点突变新生小鼠、成年小鼠模型及野生型小鼠模型上对AAV-emxABE的疗效及安全性开展评估。通过圆窗注射AAV-emxABE,在给药4周后,不同年龄段突变小鼠的听功能都得到良好的恢复。给药后20周,小鼠的治疗耳依然显示出稳定的听力水平,表明治疗具有较长期的效果。安全性研究结果显示,野生型小鼠右耳圆窗注射不同剂量药物后观察8个月,小鼠听功能、动物行为体征及血液学、组织病理学均未见异常,提示药物注射安全性良好。
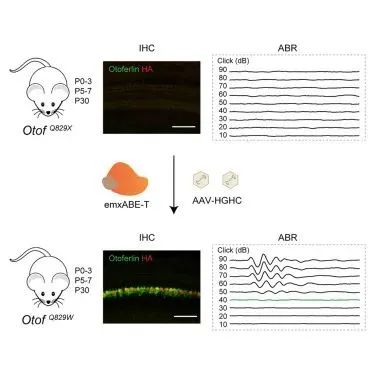
图2 AAV-emxABE开展OTOF基因编辑治疗示意图
综上所述,本研究通过单个AAV载体携带CRISPR/Cas13 RNA单碱基编辑系统emxABE,实现了OTOF Q829X遗传性耳聋小鼠安全有效的递送及更高的治疗效率,首次利用单AAV递送mRNA编辑工具实现遗传性耳聋模式动物的听力恢复,从而为遗传性耳聋开启精准基因治疗的新领域,其临床转化将有望使更多患者从中获益。目前上海交通大学医学院附属第九人民医院已经批准研究者发起的“儿童OTOF Q829X突变先天性耳聋患者单次圆窗内耳给药的安全性及耐受性”的临床研究,目前正在招募受试者,将推动基于基因编辑的遗传性耳聋的精准基因治疗。
上海交通大学医学院附属第九人民医院吴皓教授、辉大生物杨辉教授为文章共同通讯作者,薛媛媛、陶永和王兴为共同第一作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


