Nature Chemistry:浙江大学顾臻团队开发基于液-液相分离的新型药物递送平台
来源:生物世界 2025-01-16 09:47
在荷瘤小鼠模型中,研究团队证明了凝聚体囊泡能够纳入溶瘤病毒,赋予其更强大的溶瘤功效,促进溶瘤病毒的驻留和抗肿瘤免疫反应,从而抑制肿瘤生长并增强生物治疗的效果。

浙江大学药学院顾臻、李洪军、中国医科大学附属第一医院刘福囝等人在 Nature 子刊 Nature Chemistry 上发表了题为:Coacervate vesicles assembled by liquid–liquid phase separation improve delivery of biopharmaceuticals 的研究论文。
该研究开发了一种由胆固醇修饰的 DNA 和组蛋白通过液-液相分离(LLPS)形成的凝聚体囊泡,这种凝聚体囊泡表面没有膜结构,而是由高密度液体层和充满水的空腔组成,可作为包括病毒颗粒、mRNA、细胞因子和多肽在内的各种生物制剂的多功能递送载体,研究团队进一步证明了这种凝聚体囊泡能够改善溶瘤病毒的递送并在体内引发强大的抗肿瘤免疫反应。

之前的研究已经观察到了细胞内由液-液相分离(LLPS)形成的无膜细胞器。由于其易于跨膜传递、高效招募治疗药物以及保持有效载荷的生物活性,这些无膜隔室具有作为递送平台的巨大潜力。然而,体外液 - 液相分离(LLPS)组装体的动态结构特性往往由于聚结和解体而无法满足长期储存和给药的要求。
两亲分子的界面自组装以及辅助表面活性剂的内源性重构被用于稳定凝聚体并调整其界面张力。值得注意的是,这些膜化隔室引发了人们对物理边界限制扩散以及通过界面相互作用进行复杂重构过程的担忧。
受囊泡隔室的启发,研究团队开发一种基于核酸-蛋白质复合体的液-液相分离囊泡组装体(LLPS vesicular assembly),其在胆固醇修饰的单链 DNA(Chol-ssDNA)和组蛋白的特定组成下发生自组装。
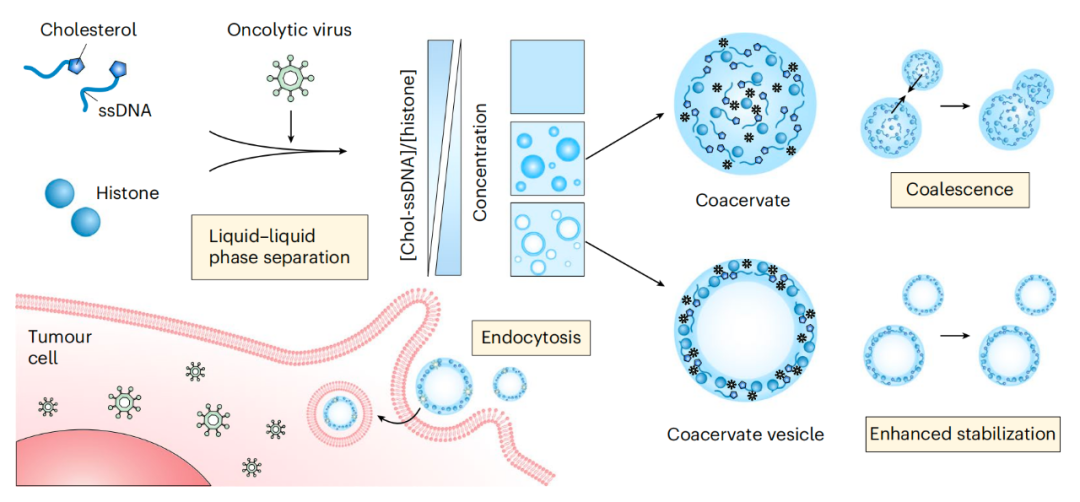
重要的是,该研究进一步证明了这种凝聚体囊泡是由一层高密度液体层包裹且稳定的。凝聚体囊泡能够在温和条件下安全、有效地隔离包括病毒颗粒、mRNA、细胞因子、多肽在内的生物制药并保持其生物活性,还能在体外和体内提高其输送效率。
与容易出现聚集问题的液滴状凝聚体相比,凝聚体囊泡具有更出色的动力学稳定性,使其成为生物制药的多功能递送载体。
具体而言,这种凝聚体囊泡递送载体能够通过不依赖受体而依赖能量的巨胞饮(macropinocytosis)作用,使溶瘤病毒(腺病毒 11 型)进入肿瘤细胞的效率提高 48 倍。
在荷瘤小鼠模型中,研究团队证明了凝聚体囊泡能够纳入溶瘤病毒,赋予其更强大的溶瘤功效,促进溶瘤病毒的驻留和抗肿瘤免疫反应,从而抑制肿瘤生长并增强生物治疗的效果。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


