《细胞》子刊:肠道真菌也能「伤心」!中国科学家发现,肠道白色念珠菌能够促进动脉粥样硬化进展,并揭示其中机制
来源:奇点糕 2024-06-15 09:54
肠道中过多的白色念珠菌会通过其代谢物甲酰甲硫氨酸激活HIF-2α-神经酰胺途径,促进动脉粥样硬化进展,而HIF-2α选择性抑制剂能够减少斑块,提供了一种潜在的新疗法。
肠道微生物的研究主要集中在肠道细菌中,但近年来,陆续有研究揭示,肠道真菌具有独特的代谢功能,也广泛参与了人类健康的维持,例如,促进次级淋巴器官的成熟[1],在结肠炎和甲流病毒感染时发挥保护作用[2]。
另外,部分肠道真菌也是疾病的风险因素,马拉色菌属真菌能够从肠道迁移到胰腺中,加速肿瘤进展[3];酿酒酵母增强嘌呤代谢和尿酸产生,导致肠道通透性增加,结肠炎恶化[4]等等。
近日,北京大学第三医院庞艳莉和杭婧、北京大学姜长涛和北京协和医院张抒扬带领的团队在《细胞·宿主&微生物》杂志上发表最新研究成果[5],他们发现,血脂异常与肠道白色念珠菌丰度升高有关,促进了动脉粥样硬化进展,这是通过白色念珠菌的代谢物甲酰甲硫氨酸激活肠道缺氧诱导因子2α(HIF-2α)-神经酰胺途径达成的。

研究确定了肠道真菌在动脉粥样硬化进展中的作用,并强调了肠道HIF-2α-神经酰胺途径作为动脉粥样硬化治疗靶点的潜力。
研究人员招募了30名血脂异常(总胆固醇[TC]≥5.2mmol/L)患者和30名健康对照,患者的血浆胆固醇和低密度脂蛋白胆固醇(LDL-C)水平较高,粪便样本测序显示,患者的白色念珠菌丰度显著高于健康对照,白色念珠菌的丰度与血浆TC和LDL-C水平呈正相关关系。
研究人员对动脉粥样硬化模型小鼠进行了3天的抗生素处理,然后分组分别定植白色念珠菌或酿酒酵母,并使用高胆固醇饮食喂养。与酿酒酵母组和磷酸缓冲液(PBS)对照组相比,白色念珠菌组小鼠的主动脉根部和整个主动脉的粥样硬化斑块负担更重,血浆TC、肝脏胆固醇和血浆、肝脏甘油三酯水平均升高。这表明,白色念珠菌促进了动脉粥样硬化进展。
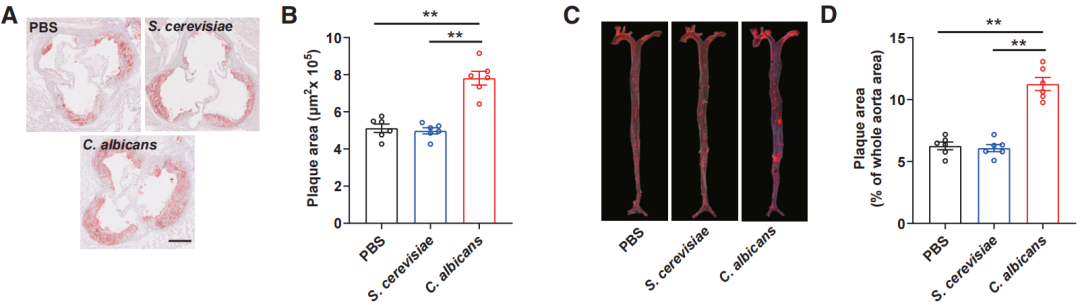
白色念珠菌组(红)的斑块大小和大小占比均更高
在探讨其中的机制的过程中,研究人员首先排除了肠道细菌的影响,因为肠道真菌的失调会影响肠道细菌的组成,肠道细菌失调也是动脉粥样硬化的风险因素。他们发现,给无菌小鼠定植白色念珠菌,再进行高胆固醇饮食喂养,在没有肠道细菌的情况下,小鼠的斑块负担仍然加重了,也就是说,白色念珠菌不是通过影响肠道细菌,间接地促进了动脉粥样硬化。
确定这一点后,研究人员又对小鼠的肠上皮细胞进行了测序,他们发现,与对照组相比,白色念珠菌组的缺氧反应富集,缺氧诱导因子2α(HIF-2α)表达显著增加,在特异性敲除了肠道Hif2α的小鼠中,动脉粥样硬化斑块、血浆和肝脏的胆固醇和甘油三酯,以及血浆的LDL-C和极低密度脂蛋白胆固醇(VLDL-C)水平较低,主动脉根部的炎症巨噬细胞浸润较少。
不仅如此,他们还发现,Hif2α敲除小鼠的肠道和血浆中神经酰胺水平也较低,神经酰胺是动脉粥样硬化的独立风险因素。在血脂异常患者的血浆样本中,也发现了高水平的神经酰胺。

血脂异常患者(红)的血浆样本中,神经酰胺水平更高
神经酰胺主要由3种途径合成:从头合成途径、鞘磷脂酶途径和补救途径,HIF-2α过表达显著上调了3种途径,而消除肠上皮细胞中的HIF-2α显著下调了鞘磷脂酶途径和补救途径。
相关性分析显示,白色念珠菌和患者血浆神经酰胺水平呈正相关关系。白色念珠菌促进了HIF-2α介导的转录活性,为了搞清楚是什么激活了HIF-2α信号通路,研究人员鉴定了254种白色念珠菌的代谢物,其中甲酰甲硫氨酸具有最强的激活能力,甲酰甲硫氨酸单独补充2周即可诱导小鼠HIF-2α信号传导和神经酰胺和合成。
在血脂异常患者的粪便样本中也检测到了高于健康对照的甲酰甲硫氨酸水平,甲酰甲硫氨酸水平与血浆胆固醇和神经酰胺水平呈正相关关系。
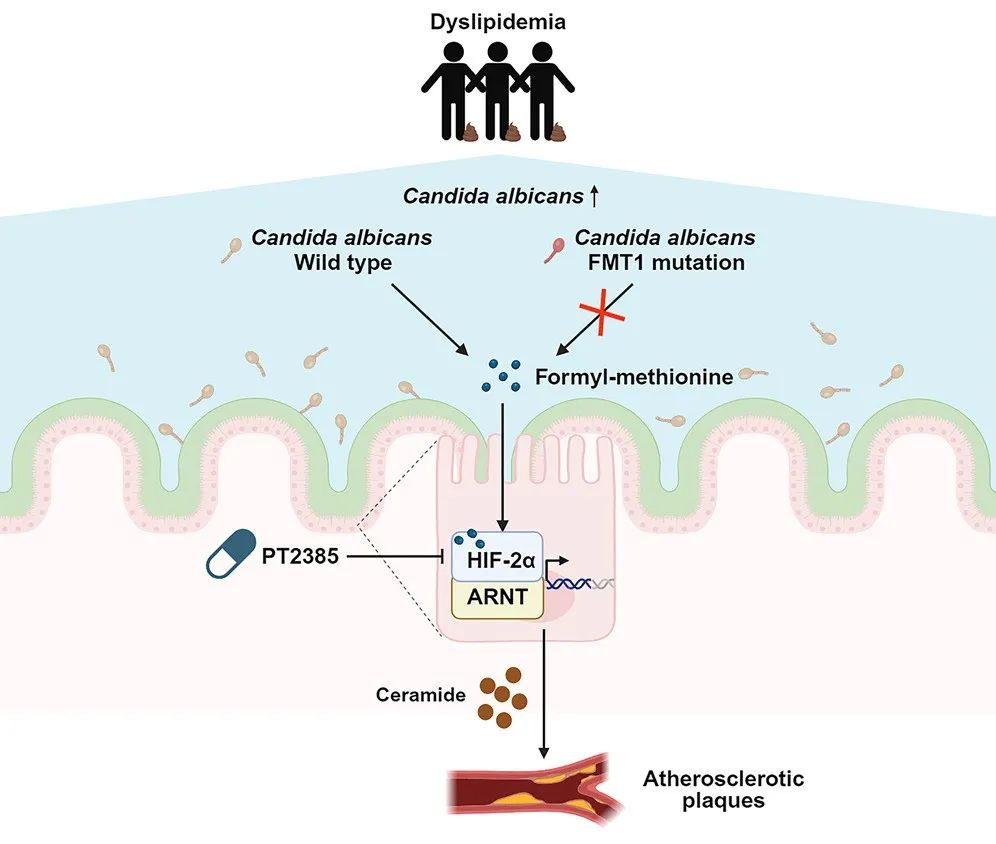
基于以上机制,研究人员使用HIF-2α选择性抑制剂PT2385对动脉粥样硬化小鼠进行了治疗。与PBS对照相比,PT2385在未影响体重的情况下减少了动脉粥样硬化斑块,轻微抑制了肝脏胆固醇水平。小鼠肠道内神经酰胺合成减少,血浆和肠道的神经酰胺水平也相应下降。
综上,肠道中过多的白色念珠菌会通过其代谢物甲酰甲硫氨酸激活HIF-2α-神经酰胺途径,促进动脉粥样硬化进展,而HIF-2α选择性抑制剂能够减少斑块,提供了一种潜在的新疗法。
参考文献:
[1] Zhang Z, Li J, Zheng W, et al. Peripheral lymphoid volume expansion and maintenance are controlled by gut microbiota via RALDH+ dendritic cells[J]. Immunity, 2016, 44(2): 330-342.
[2] Jiang T T, Shao T Y, Ang W X G, et al. Commensal fungi recapitulate the protective benefits of intestinal bacteria[J]. Cell host & microbe, 2017, 22(6): 809-816. e4.
[3] Aykut B, Pushalkar S, Chen R, et al. The fungal mycobiome promotes pancreatic oncogenesis via activation of MBL[J]. Nature, 2019, 574(7777): 264-267.
[4] Chiaro T R, Soto R, Zac Stephens W, et al. A member of the gut mycobiota modulates host purine metabolism exacerbating colitis in mice[J]. Science translational medicine, 2017, 9(380): eaaf9044.
[5] Wang X, Zhou S, Hu X, et al. Candida albicans accelerates atherosclerosis by activating intestinal hypoxia-inducible factor2α signaling[J]. Cell Host & Microbe, 2024.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


