《癌细胞》:重新定义乳腺癌亚型,发现个性化治疗新方法
来源:奇点糕 2022-07-25 09:35
乳腺癌是女性中发病率最高的癌症,且在全球绝大数国家乳腺癌的死亡率居首位。
乳腺癌是女性中发病率最高的癌症,且在全球绝大数国家乳腺癌的死亡率居首位。
据统计,2020年全球女性乳腺癌新发病例2261419例,死亡病例684996例,分别占女性癌症新发和死亡总数的24.5%和15.5%。根据以上数据,研究人员推算出,乳腺癌标化发病率和死亡率分别为47.8/10万和13.6/10万,0~74岁累积发病和死亡风险分别为5.20%和1.49%[1]。
得益于过去几十年的医学进步,乳腺癌的治疗有所改善。通过化疗、放疗结合手术治疗,患者可达到90%或者更高的存活率。这种临床获益,在到一定程度上也得益于乳腺癌的分型,尤其是基于HR和HER2的分型,让患者从相关的内分泌疗法与靶向疗法获益。
然而,近年来,乳腺癌靶向疗法正在不断扩展,包括铂类药物、PARP抑制剂、PIK3CA抑制剂、mTOR抑制剂,以及以特异性针对HR/HER2亚型的双重靶向HER2治疗方案和免疫治疗方案等[2-3]。
以上疗法涉及的机制,已经远超出HR/HER2表达囊括的范围,仅以HR/HER2作为评判标准具有一定的局限性。因此,探索HR/HER2之外的分子标志物,对于乳腺癌患者的个性化治疗必然十分有益。
近日,由美国加州大学Laura J. van't Veer,Christina Yau和Denise M. Wolf领衔的研究团队,在Cancer Cell杂志上发表重要研究成果。
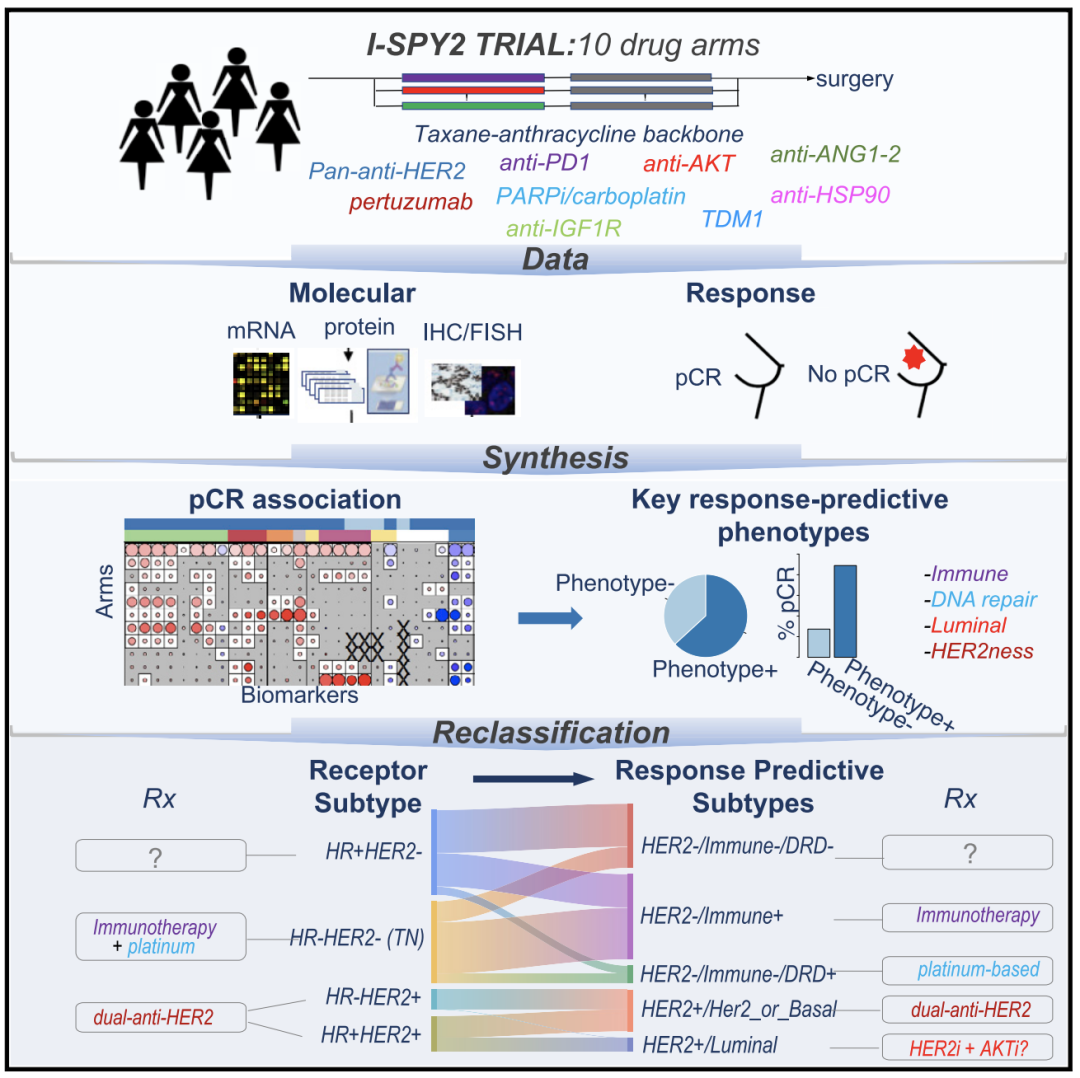
他们基于10种不同方案治疗约990名乳腺癌患者的数据,提出>11种乳腺癌亚型并确定与之相匹配的治疗方案,并确定了能够最大化整个患者群体病理完全缓解(pCR)率的治疗方案和乳腺癌亚型对。
使用他们提出的个性化治疗方案,能将患者群体的pCR率,从基于HR/HER2指导治疗的51%提高到63%。

论文首页截图
接下来,我们就一起来看看van't Veer团队是如何开展这项研究的。
这项研究是基于I-SPY2展开的。I-SPY2是一项正在进行的,多中心II期新辅助平台试验,旨在为高危早期乳腺癌患者提供最佳疗法。I-SPY2中的治疗方案建立在标准疗法之上,即在紫杉醇周期疗法和化疗的基础上联用多种新型药物。
患者根据I-SPY2的适应性随机反应原则分配到不同的联合用药试验组中,以达到pCR作为试验成功标准。研究表明,I-SPY2试验显著提升了乳腺癌的pCR,患者的预后得到极大改善[4]。
在I-SPY2试验中,患者在治疗前会先对肿瘤细胞进行分离纯化,以获得肿瘤上皮、间质和肿瘤内免疫细胞,通过基因表达阵列和反向蛋白阵列(RPPA)检测基因表达和蛋白/磷酸化水平。
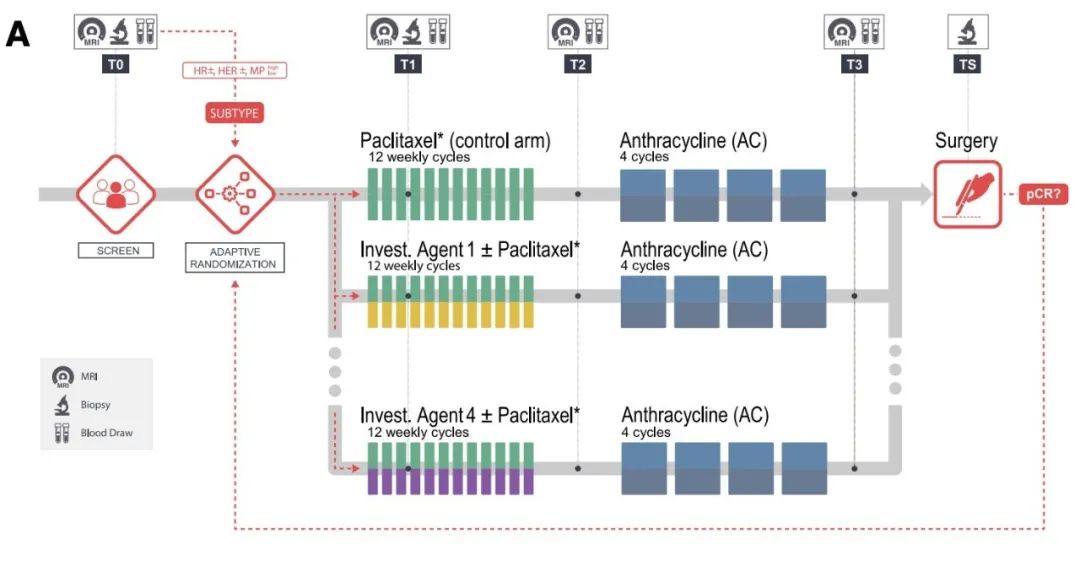
试验设计
这项试验共有987位患者入组。这些患者基于HR/HER2分型可被分为HR+HER2-型(38%),HR-HER2-型(37%)和HER2型(25%);而根据MP等级分类可被分为MP1型(51%)和MP2型(49%)。
I-SPY2试验设置10个组别。其中210位患者被纳入对照组;71位患者被纳入veliparib/卡铂组;93位患者被纳入AKT抑制剂组;106位患者被纳入ganitumab组;94位患者被纳入HSP抑制剂组;134位患者被纳入ANG1/2抑制剂组;52位患者被纳入TDM1/帕妥珠单抗组;44位患者被纳入帕妥珠单抗组;69位患者被纳入帕博利珠单抗组。最终6个试验组成功达到预期效果,3个试验组未达到预期目标。
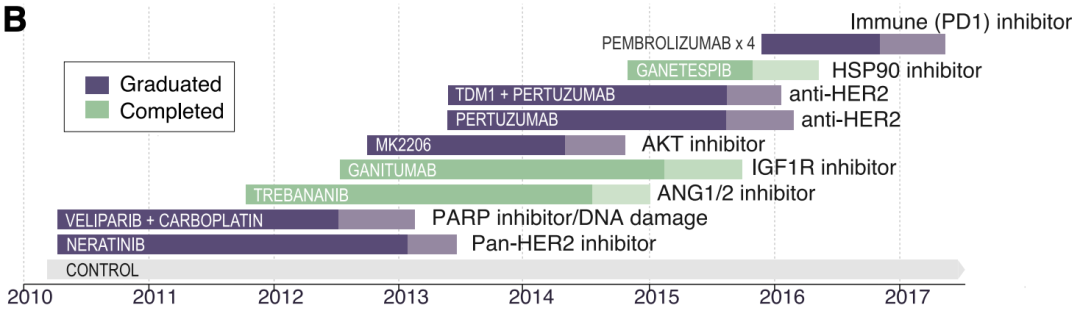
10个组别
而若根据HR/HER2对患者进行分型,即使在治疗效果最好的试验组中依然有70%的HR+HER2-患者,40%的HR-HER2-患者和26%的HR-HER2+患者未达到pCR由此可见,进一步探究更优的生物标志物和更精准的乳腺癌分型对精准治疗十分必要。
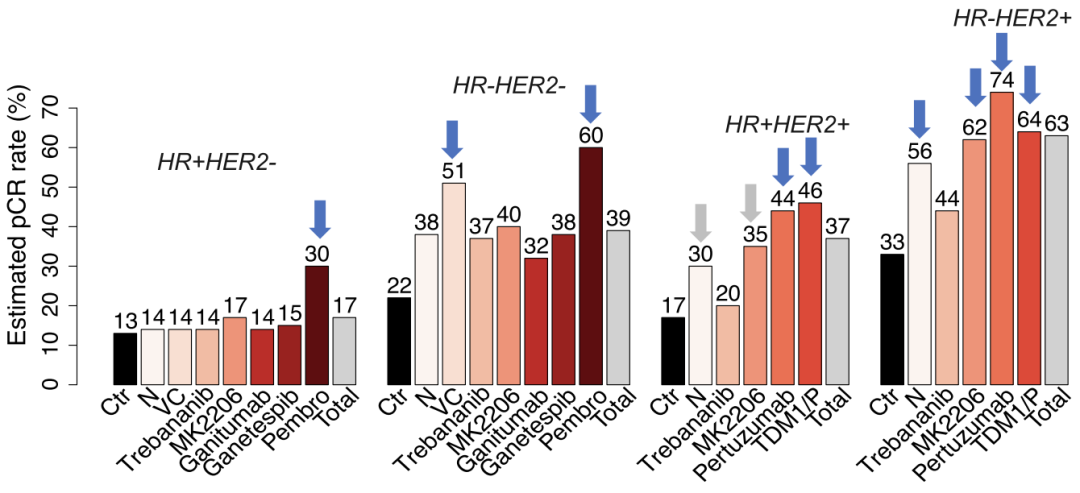
根据HR/HER2对患者进行分型的pCR率
研究人员对除ganitumab组和HSP抑制剂组外的739位患者进行了全转录组测序。
基于基因表达和蛋白/磷酸化特点,鉴定出27种不同作用机制的合格生物标志物,并对这些生物标志物进行了富集分析。
结果发现,这些生物标志物均能被富集到生物学相关通路中,且这些通路相比于HR/HER2能够更好地对患者分型。
研究人员进一步将这些生物标志物与10个试验组的pCR和不同亚型之间进行相关性比较,发现这27种生物标志物不仅在某一个试验组中表现突出,而是具有更广泛的预测作用,尤其在免疫、增殖以及ER/Luminal通路中具有最高的预测价值。
基于这些合格的生物标志物,研究人员创新地提出治疗反应预测亚型(RPSs),即在HR/HER2的基础上添加了Proliferation、DRD、Immune、Luminal、Basal和HER2ness分型标准,以供排列组合。
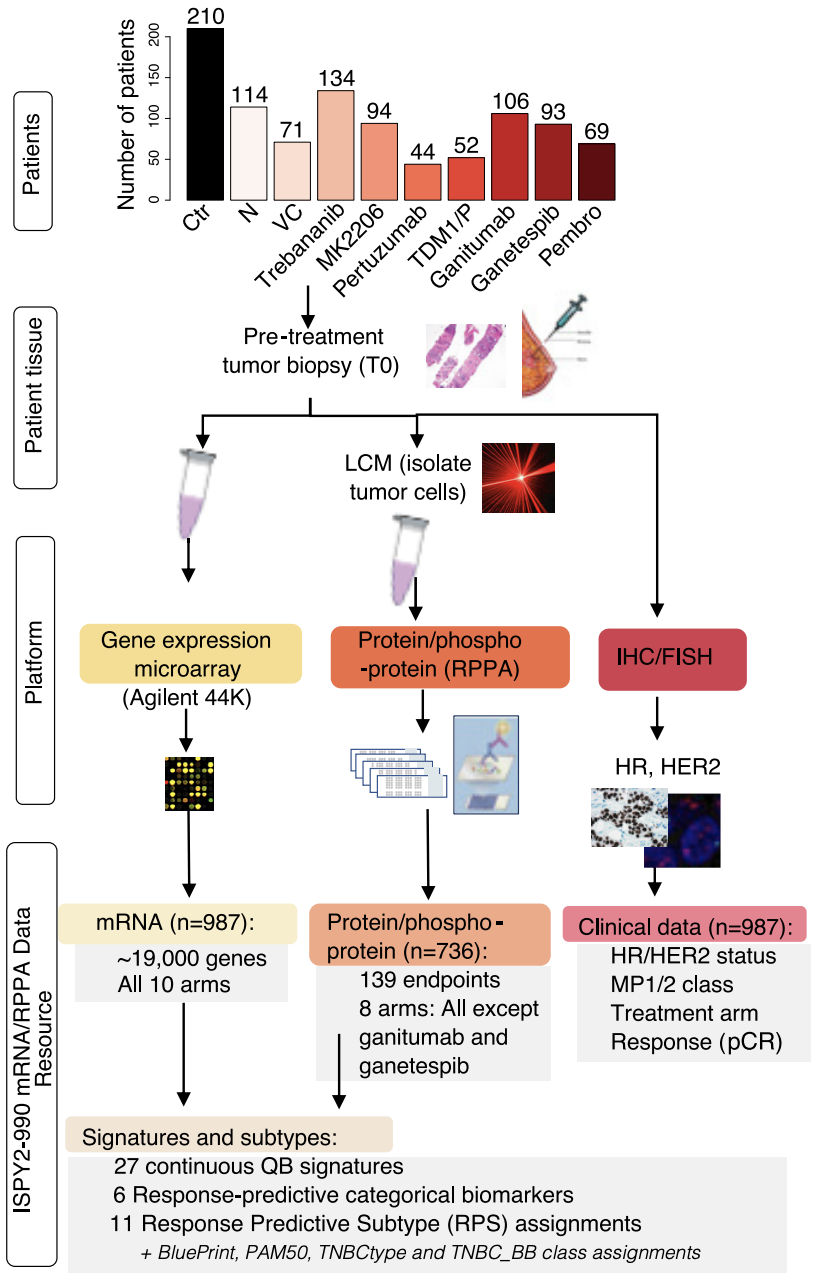
研究涉及的数据类型
他们首先组合出5种亚型(RPS-5),发现用RPS-5与相应的治疗方案时,患者的总体pCR率能够达到58%,相比基于HR/HER2的分型方法提高了7%。然而该分型标准存在亚型依赖性,一些亚型的患者并没有观察到明显的pCR率升高,并且考虑到未来试验中可能增加新药,他们进一步提出了RPS-7分型标准。
这种分型方法使患者的pCR率相比基于HR/HER2的分型方法提升11%。这些结果提示我们不同的分型标准能够影响患者的用药和pCR率,因此RPSs有助于帮助患者确定用药优先级,进而最大限度地提高患病人群的整体pCR。
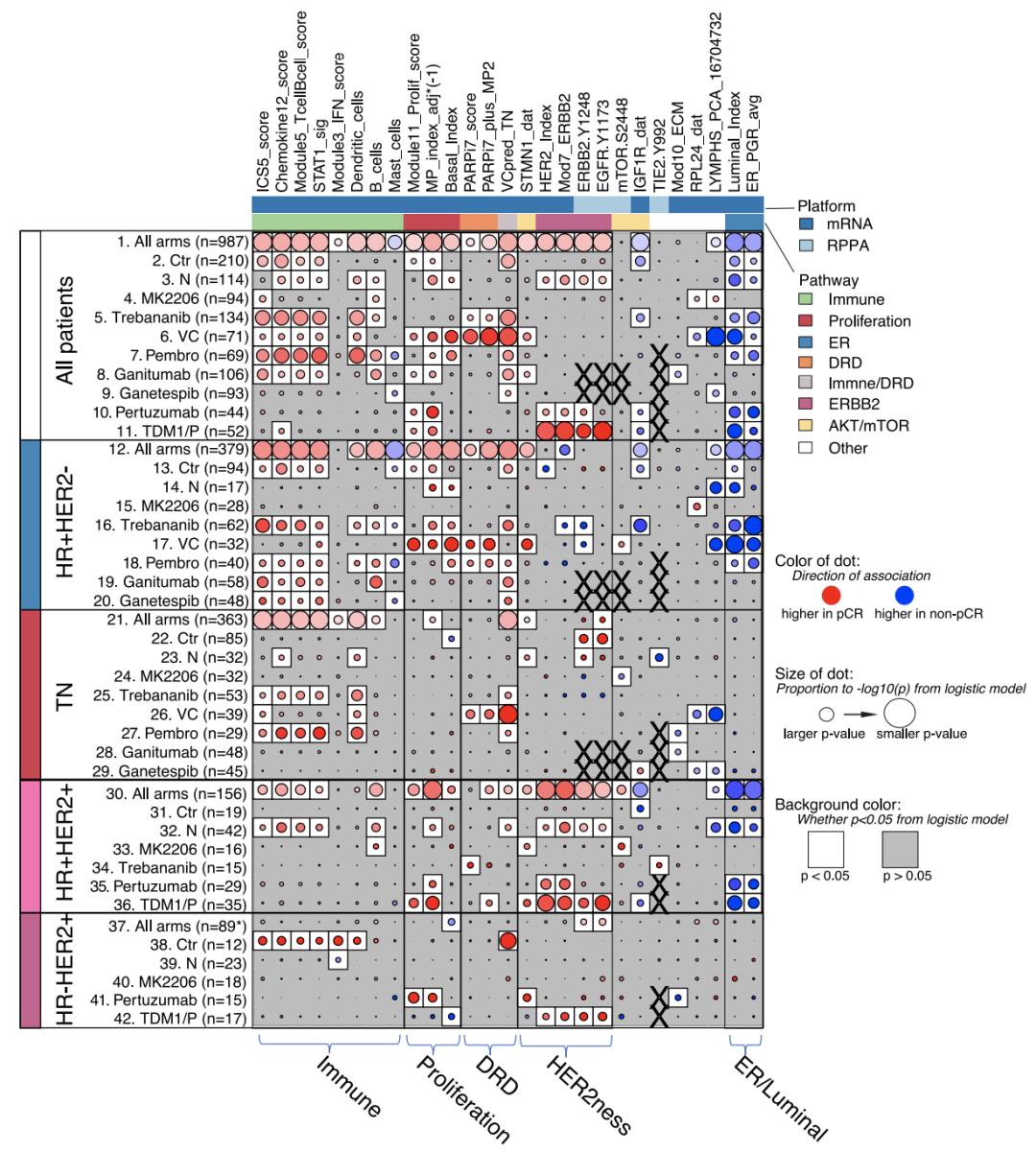
pCR相关性分析
总的来说,这项研究提供了一个全新的数据平台,鉴定出27种具有不同作用机制的生物标志物,并基于这些生物标志物将乳腺癌患者分为超过11种亚型,利用RPSs分型指导患者的用药优先级,进而最大程度地提高整个人群的治疗效果。
这个平台有望继续发展,研究人员计划将RPSs应用于I-SPY2.2研究中,在I-SPY2的基础上添加顺序多任务随机试验(SMART)方案,从而根据个体生物学与特异性反应进行适应性治疗。
这一系列研究对乳腺癌的个性化治疗和药物研发具有重要意义,为乳腺癌患者带来了巨大的福音。
参考文献:
[1].Rongshou Zheng, Siwei Zhang, Hongmei Zeng, Shaoming Wang, Kexin Sun, Ru Chen, Li Li, Wenqiang Wei, Jie He,Cancer incidence and mortality in China, 2016, Journal of the National Cancer Center, 2022, ISSN 2667-0054, dio:10.1016/j.jncc.2022.02.002
[2]Bergin ART, Loi S. Triple-negative breast cancer: recent treatment advances. F1000Res. 2019;8:F1000 Faculty Rev-1342. Published 2019 Aug 2. doi:10.12688/f1000research.18888.1
[3] McAndrew NP, Finn RS. Management of ER positive metastatic breast cancer. Semin Oncol. 2020;47(5):270-277. doi:10.1053/j.seminoncol.2020.07.005
[4]Nanda R, Liu MC, Yau C, et al. Effect of Pembrolizumab Plus Neoadjuvant Chemotherapy on Pathologic Complete Response in Women With Early-Stage Breast Cancer: An Analysis of the Ongoing Phase 2 Adaptively Randomized I-SPY2 Trial. JAMA Oncol. 2020;6(5):676-684
[5] Wolf DM, Yau C, Wulfkuhle J, et al. Mechanism of action biomarkers predicting response to AKT inhibition in the I-SPY 2 breast cancer trial. NPJ Breast Cancer. 2020;6:48. Published 2020 Oct 2. doi:10.1038/s41523-020-00189-2
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


