NCB:斯坦福大学团队发现,溶酶体功能障碍是阿尔茨海默病的早期事件,为AD治疗带来新思路
来源:网络 2025-04-14 09:33
研究人员利用人类皮肤成纤维细胞,并通过转分化技术,开发了可以保留衰老表型,以及反映AD早期病理事件的神经元模型,即转分化神经元(tNeurons)。
近期,美国斯坦福大学Ching-Chieh Chou和Judith Frydman团队发表了一项重要研究成果。他们利用人类皮肤成纤维细胞,并通过转分化技术,开发了可以保留衰老表型,以及反映AD早期病理事件的神经元模型,即转分化神经元(tNeurons)。
具体来说,在构建的AD tNeurons中,研究人员先是观察到,β-淀粉样蛋白(Aβ)和磷酸化tau蛋白沉积的现象,这与AD大脑中的情况类似。其次,通过对不同tNeurons模型进行蛋白质组学分析,研究人员揭示了衰老和AD相关的蛋白质稳态和细胞器功能障碍的差异,其中溶酶体功能障碍会在衰老tNeurons中出现,并在AD tNeurons中加剧,且在这一模型中,溶酶体功能障碍与炎症因子的分泌有关。
而使用改善溶酶体功能的小分子化合物,则能减少Aβ42沉积和炎症因子分泌,从而缓解AD病理特征。这提示,溶酶体功能障碍可能是衰老和AD的早期关键事件。
研究发表在Nature Cell Biology上[1]。

论文首页截图
为了构建合适的神经元模型,研究人员分别从8名健康年轻供体(年龄25.6±4.9岁)、12名老年供体(年龄70.3±5.9岁)、16名散发性AD老年患者(年龄70.4±9.2岁)中收集了皮肤成纤维细胞,然后利用转录因子,将这些皮肤成纤维细胞转化为皮质神经元,tNeurons。
随后,研究人员发现,这些tNeurons可以保留供体成纤维细胞的年龄和疾病特征,比如从老年,以及AD供体中转分化的神经元,会出现DNA损伤增加、组蛋白修饰变化等特征,且在基础条件下,就表现出了明显的蛋白质稳态失调(表现为泛素阳性,以及自噬受体p62/SQSTM1颗粒积累增加)。
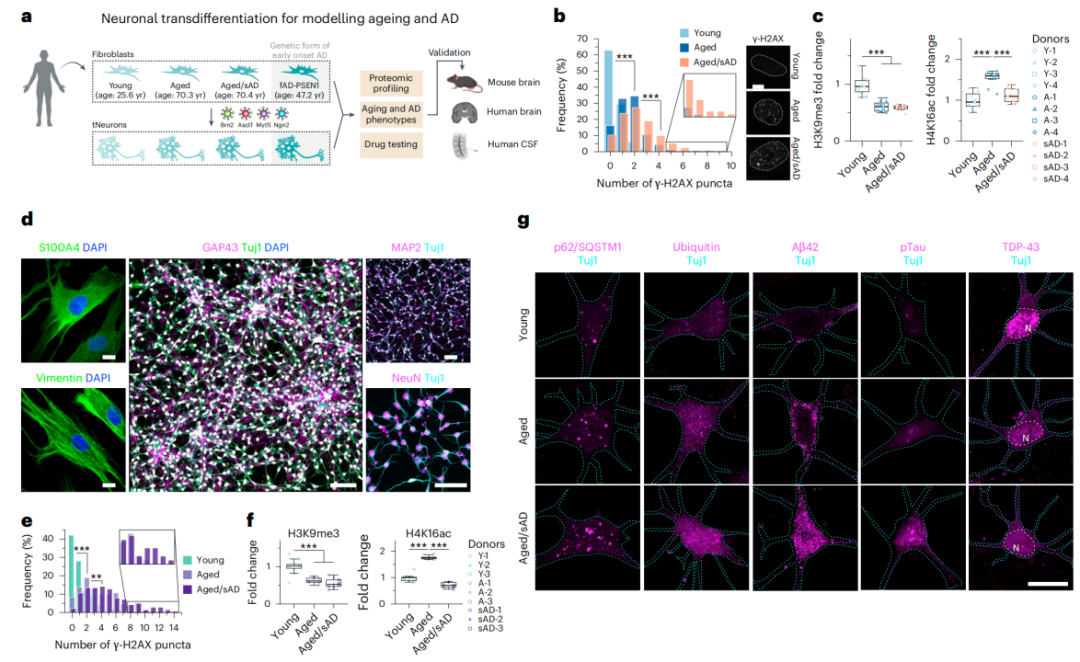
模型建立,以及模型表现出的衰老和疾病特征
更重要的是,在AD tNeurons中,研究人员还观察到总Aβ、Aβ42、磷酸化tau蛋白,以及TDP-43的沉积显著增加的现象。以上结果提示,神经元蛋白稳态失调会因衰老和AD而加剧,这可能进一步促进了多种AD相关病理蛋白的积累。
接下来,通过对来自不同供体的tNeurons模型进行蛋白质组学分析,研究人员发现,衰老和AD相关的蛋白质稳态和细胞器功能障碍存在明显差异,其中溶酶体功能障碍会在衰老tNeurons中出现,并在AD tNeurons中进一步加剧。
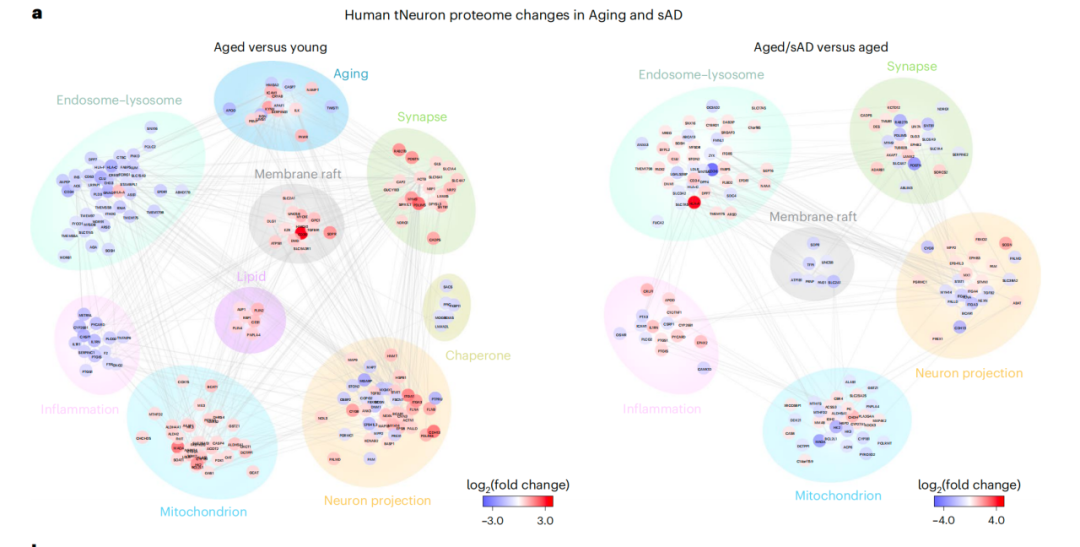
蛋白组学分析
具体来说,利用透射电子显微镜,研究发现,相比衰老tNeurons,AD tNeurons中溶酶体损伤和修复缺陷更为严重,表现为溶酶体体积增大、电子致密颗粒数量增多、线粒体-溶酶体接触的增加、溶酶体损伤标志物(如CHMP2B和galectin-3)水平积累增加,以及溶酶体损伤修复明显延迟。
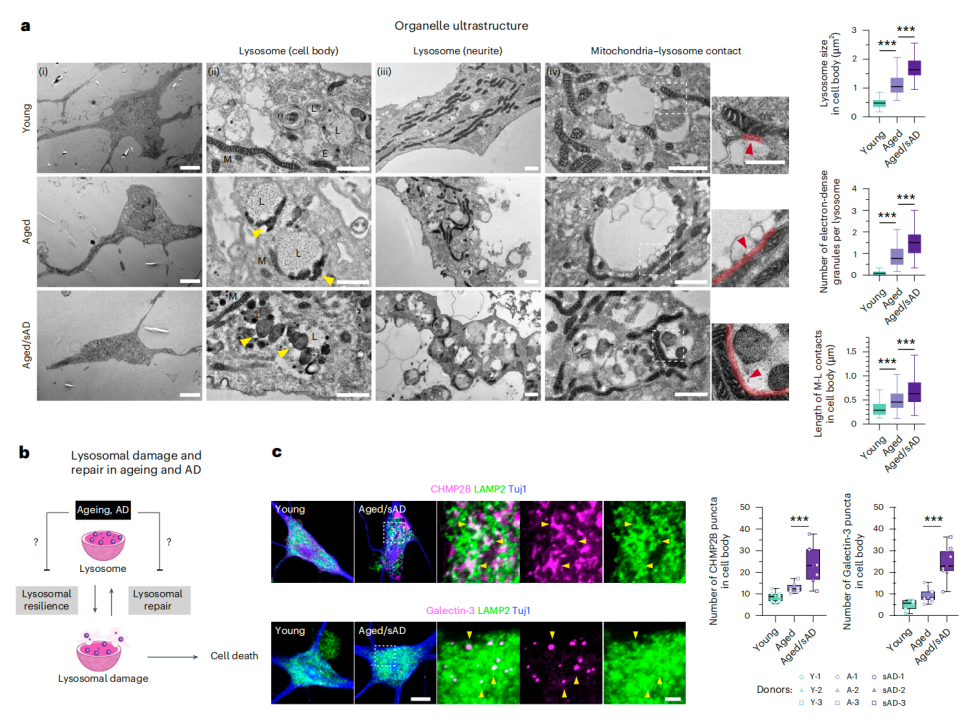
AD tNeurons中,溶酶体损伤更严重
进一步,在观察溶酶体功能障碍与蛋白质稳态之间的关系时,研究人员发现,溶酶体损伤会导致TDP-43异常定位,并与Aβ42沉积密切相关。
此外,研究发现,溶酶体损伤不仅影响蛋白稳态,还与神经炎症反应相关,尤其在AD tNeurons中,溶酶体损伤还会增加炎症因子(如IL-6、IL-15和CCL2)的分泌。这表明,溶酶体损伤导致的炎症反应在AD的发病过程中起着重要作用。
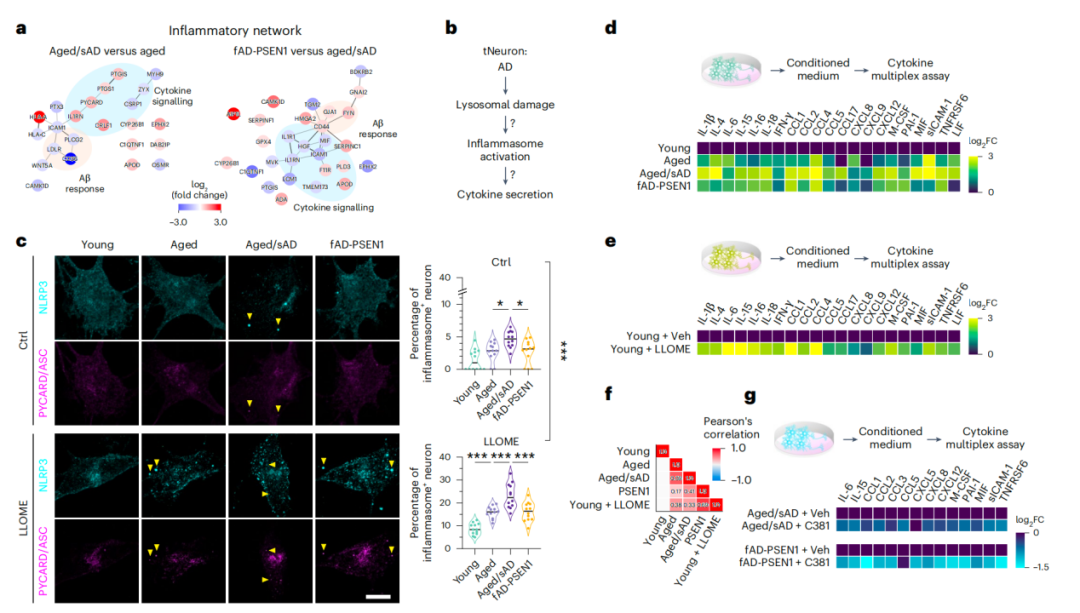
溶酶体损伤导致的炎症反应
最后,研究人员想知道药物干预能否改善溶酶体功能并减轻AD病理,结果发现,使用小分子溶酶体功能增强剂(如c381、thioperamide、NCT-504),不仅可以有效修复溶酶体结构缺陷,降低溶酶体损伤标志物水平的积累,还能减少Aβ42沉积和炎症因子分泌,从而缓解AD病理特征。
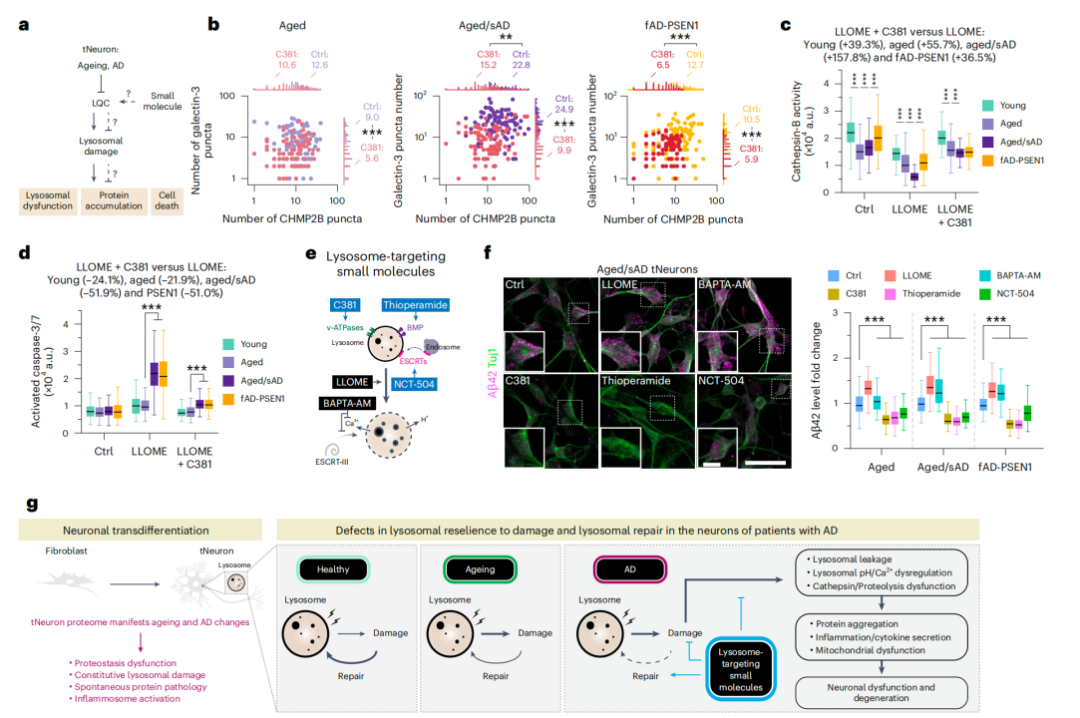
溶酶体功能恢复对AD病理的影响
总之,该研究通过开发可以保留衰老表型,以及反映AD早期病理事件的神经元模型,揭示了溶酶体功能障碍是衰老和AD早期的重要事件,这些发现不仅提示了溶酶体功能障碍在AD病理中的作用,还为开发针对溶酶体功能的治疗策略提供了理论依据。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


