盘点:2022年终盘点:衰老领域重要研究成果解读
来源:生物谷原创 2022-12-27 14:22
时至岁末,转眼间2022年已经接近尾声,迎接我们的将是崭新的2023年,在即将过去的2022年里,科学家们在机体衰老研究领域取得了多项重要研究成果,本文中,小编就对本年度科学家们在该研究领域取得的重磅
时至岁末,转眼间2022年已经接近尾声,迎接我们的将是崭新的2023年,在即将过去的2022年里,科学家们在机体衰老研究领域取得了多项重要研究成果,本文中,小编就对本年度科学家们在该研究领域取得的重磅级研究成果进行整理,分享给大家!
【1】Nat Neurosci:机体适应性的免疫反应或会引发衰老大脑发生细胞损失
Kaya,T.,Mattugini,N.,Liu,L. et al. CD8+ T cells induce interferon-responsive oligodendrocytes and microglia in white matter aging. Nat Neurosci 25,1446-1457 (2022). doi:10.1038/s41593-022-01183-6
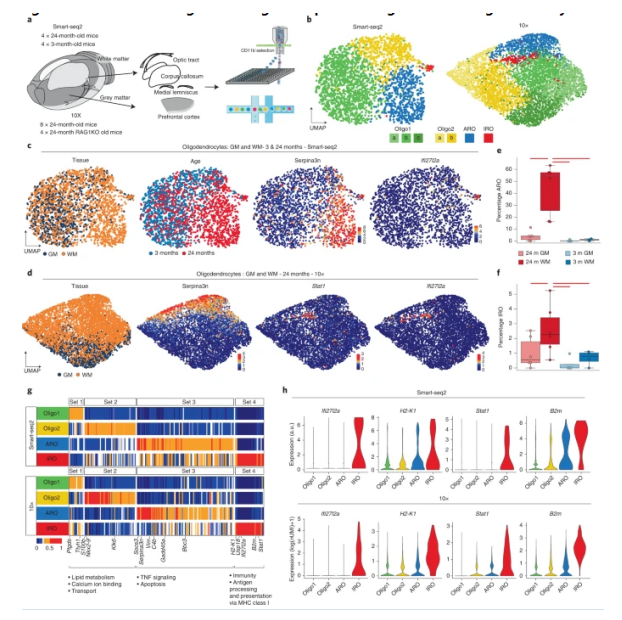
此前的神经科学研究一直表明,哺乳动物机体神经系统的衰老与大脑白质(大脑深层组织中的神经纤维)体积和功能的下降相似,尽管这一研究发现已经得到证实,但科学家们对于大脑白质减少及其相关的病理学发生背后的分子机制却知之甚少。近日,一篇发表在国际杂志Nature Neuroscience上题为“CD8+ T cells induce interferon-responsive oligodendrocytes and microglia in white matter aging”的研究报告中,来自德国慕尼黑大学等机构的科学家们通过研究进行了一项研究,旨在更好地理解导致机体大脑白质退化的神经分子机制,相关研究结果表明,适应性的免疫反应或许会促进衰老大脑白质中细胞的流失。
机体适应性的免疫反应或会引发衰老大脑发生细胞损失。
图片来源:Nature Neuroscience (2022). DOI:10.1038/s41593-022-01183-6
研究者Mikael Simons表示,大脑衰老的标志之一就是大脑白质体积和功能的降低,其会导致机体神经系统疾病的增加,大脑白质中含有神经纤维(轴突),其是神经细胞(神经元)的延伸,其中很多神经纤维能被一类名为髓鞘的覆盖物所包围,从而就会促进机体神经元快速沟通交流,并使得白质具有一定的颜色。
本文研究中,研究人员旨在更好地理解随着机体衰老哺乳动物大脑中白质功能下降的原因,从而识别出大脑细胞对衰老的特定反应,在此前的一些研究中,研究人员发现了机体衰老或与大脑白质的改变存在一定的关联,这或许就会促使小胶质细胞(大脑中定植的免疫细胞)的反应性更强。研究者表示,在此前研究中我们发现,小胶质细胞能帮助清理衰老诱导的髓鞘损伤,本文中我们继续跟进研究并尝试理解这些改变是如何发生的以及重点分析了少突胶质细胞(中枢神经系统中的髓鞘细胞)的作用,因为其会在机体衰老过程中不断丧失。
综上,本文研究结果提供了相关证据表明,CD8+ T细胞所诱导的干扰素反应性的少突胶质细胞和小胶质细胞或许是机体大脑白质衰老的重要修饰因素。
【2】Sci Transl Med:科学家发现一种新型RNA作用靶点和工具来帮助抵御人类过早衰老
Francesco Della Valle,Pradeep Reddy,Mako Yamamoto,et al. LINE-1 RNA causes heterochromatin erosion and is a target for amelioration of senescent phenotypes in progeroid syndromes,Science Translational Medicine (2022). doi:10.1126/scitranslmed.abl6057
组成型异染色质(constitutive heterochromatin)主要负责对富含重复序列、端粒和中心粒的DNA进行基因组的抑制。近日,一篇发表在国际杂志Science Translational Medicine上题为“LINE-1 RNA causes heterochromatin erosion and is a target for amelioration of senescent phenotypes in progeroid syndromes”的研究报告中,来自阿布杜拉国王科技大学等机构的科学家们通过研究发现了一种新型的RNA靶点和工具来抵御机体的过早衰老。
早衰综合征(progeroid syndromes)是一组罕见的遗传性障碍,其会引发儿童和年轻人出现机体出现过早衰老的迹象,比如沃纳综合征(Werner syndrome)和早年衰老综合症(Hutchinson-Gilford Progeria syndrome);受早衰综合征影响的患者通常会出现与机体衰老相关的症状和病理学表现,比如心脏病、白内障、2型糖尿病和骨质疏松症等。这种衰老的特征主要表现为核心结构的进行性缺失以及潜在的组织特异性遗传程序,但其背后的原因目前研究人员并不清楚;这篇报告中,研究人员识别出了一种新靶点,或有望通过预防核心结构的缺失来治疗这些综合征。
这种靶点被称为长散在重复序列-1(L1,long interspersed nuclear element-1)RNA,即一个重复序列家族,涵盖了17%-20%的哺乳动物基因组,然而其功能在很大程度上是未知的,这些序列能被称之为异染色质的紧密包裹DNA架构保持不活跃的状态。有研究证据表明,机体正常衰老期间异染色质的缺失往往与其激活有关,基于理论考虑,研究人员推测,L1 RNA与控制异染色质稳定性的特定酶类之间的分子关联或许就是早衰综合征患者机体发生过早衰老的原因。
研究者表示,来自早衰综合征患者机体细胞的L1 RNA的表达量会增加,进一步检测结果表明,L1 RNA表达量的增加或许主要负责失活名为SUV39H1的酶类,这种酶类会导致异染色质的缺失以及导致细胞衰老的基因表达的改变。随后研究人员通过对早衰综合征患者以及通过遗传工程化修饰刺激出现过早衰老的小鼠进行研究,阻断其机体细胞中L1 RNA的表达并逆转衰老过程的发生,同时研究者使用名为反义寡核苷酸(ASO)的短合成核苷酸链也做到了这一点,这种割肝算能特异性地靶向作用并导致L1 RNA的降解。综上,本文研究强调了在人类早衰综合征中L1 RNA在异染色质平衡中扮演的关键作用,并识别出了一种可能性的治疗性策略来帮助治疗人类机体的过早衰老和其相关的综合征。
【3】Stem Cell Rep:直接通过皮肤所产生的衰老神经元或能更加准确地模拟人类的帕金森疾病
Janelle Drouin-Ouellet,Emilie M. Legault,Fredrik Nilsson,et al. Age-related pathological impairments in directly reprogrammed dopaminergic neurons derived from patients with idiopathic Parkinson's disease,Stem Cell Reports (2022). doi:10.1016/j.stemcr.2022.08.010
近日,一篇发表在国际杂志Stem Cell Reports上题为“Age-related pathological impairments in directly reprogrammed dopaminergic neurons derived from patients with idiopathic Parkinson's disease”的研究报告中,来自蒙特利尔大学等机构的科学家们通过研究利用皮肤直接产生的老化神经元或能准确模拟人类的帕金森疾病。
研究者表示,在一个重编程过程中,从诱导多能干细胞(iPSCs)(即来自患者皮肤中的胚胎样细胞)制造人类机体几乎所有类型的细胞的可能性或许就能为在实验室中建立疾病模型开辟新的途径。然而,该技术的一个缺点就是,在重编程过程中,供体年龄特异性的细胞特征或许会被抹去,因此,由iPSCs所制造的细胞通常类似于人类胚胎或胎儿机体的细胞,而不是成年个体或老年个体机体中的细胞。诸如帕金森疾病等人类神经退行性疾病主要会影响老年人群,而且很难利用PSC衍生的神经元细胞来进行模拟,因为其缺少很多衰老神经元的决定性特征。
这篇研究报告中,研究者表示,保留神经元的衰老特征的一种方法就是直接利用人类患者的皮肤来制造这些细胞,而不是经过iPSC的中间阶段;研究人员通过将一种特殊的神经诱导基因组合引入到皮肤细胞中,成功将来自帕金森疾病患者的皮肤细胞转化成为所谓的多巴胺能神经元(DA neurons),其是一类在帕金森疾病中逐渐丧失功能的神经元类型。相比产生自iPS细胞的帕金森疾病细胞而言,直接利用皮肤细胞来产生多巴胺能神经元的过程能保留供体年龄的遗传、表观遗传学和代谢特征。
综上,本文研究结果表明,直接进行神经重编程或许能用来获得患者机体所衍生的多巴胺能神经元,其独特的功能或许能作为一种特殊的细胞模型来研究与特发性帕金森疾病相关的衰老相关的病理学表现。
【4】BBRC:科学家有望利用衰老的休眠细胞来帮助抵御人类黑色素瘤
Fanny Noulet,Rastine Merat. Inhibition of the DAPKs-L13a axis prevents a GAIT-like motif-mediated HuR insufficiency in melanoma cells,Biochemical and Biophysical Research Communications (2022). doi:10.1016/j.bbrc.2022.07.086
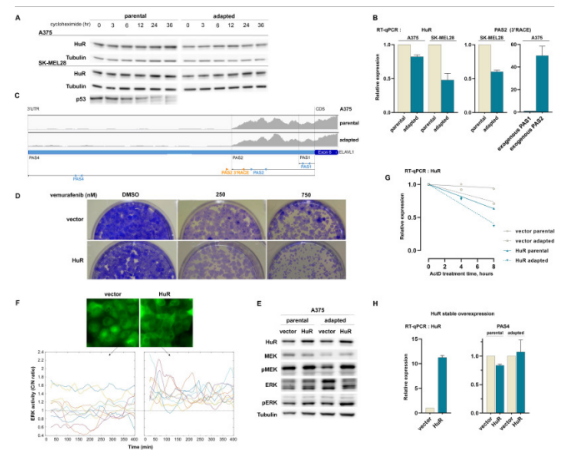
早在10年前,小分子靶向性疗法的出现彻底改变了转移性黑色素瘤的疗法,但前提是肿瘤要携带对这些疗法能产生反应的突变,然而,尽管研究人员能在大多数患者机体中观察到这些显著的初始反应,即使在非常显著的初始反应之后,其中很多患者的病情都会复发,这些复发是由于休眠的顽固细胞所致,其对疗法并没有反应。
科学家有望利用衰老的休眠细胞来帮助抵御人类黑色素瘤。
图片来源:Biochemical and Biophysical Research Communications (2022). DOI: 10.1016/j.bbrc.2022.07.086
近日,一篇发表在国际杂志Biochemical and Biophysical Research Communications上题为“Inhibition of the DAPKs-L13a axis prevents a GAIT-like motif-mediated HuR insufficiency in melanoma cells”的研究报告中,来自日内瓦大学等机构的科学家们通过研究发现,这些细胞或许对于名为HuR的蛋白表达量不足,通过解析这种表达不足的机制以及利用酶类抑制剂进行靶向作用,研究人员就能成功降低所有黑色素瘤细胞对疗法的耐受性,相关研究结果或能帮助开发抵御转移性黑色素瘤和其它实体瘤的新型疗法。
黑色素瘤是一种最危险的皮肤癌,其具有较强的侵袭性,且是从黑色素细胞发展而来,而黑色素细胞是机体中负责皮肤色素沉着的细胞;患者机体最初的肿瘤可能是浅表性的,手术切除后的预后较好,肿瘤也可能较深且具有转移性,并能迁移到机体其它器官中。在过去10年里,由于所谓的小分子靶向性疗法(即能抑制肿瘤内部的精准机制来抵御癌症)的出现,一半的转移性黑色素瘤都会携带让其对这些药物敏感的遗传性特征,因此这些黑色素瘤往往能得到有效治疗,有时甚至还能被根除。然而,尽管患者在开始治疗时会出现明显的疗效,但80%的患者都会经历黑色素瘤复发,而且这些复发往往会发生在最初受影响的相同部位。
这种现象被称为“适应性耐受性”(adaptive resistance),特定癌细胞能适用于抵御其的药物,并会导致疾病的重新出现,甚至在转移(因此其也是制造这些肿瘤的细胞)已经完全消失的情况下也会发生,这是因为在疗法后,所谓的休眠恶性细胞的少量残留物能持续存在,而传统的放射学工具却无法对其进行检测;除了不可见之外,这些细胞的特征就是其能缓慢增殖,这一特点或许就能帮助细胞躲避疗法,甚至在最初的治疗过程中也是如此。对于研究人员而言,下一步他们将会鼓励制药企业优化已经识别出的激酶的抑制剂,从而改善其稳定性和生物可利用性,而这是制药公司如今知道如何以一种非常系统性的方式来进行的研究,至少对于这种类型的目标而言是这样的。
【5】Lancet子刊:较差的心脏健康状况或能预测机体大脑过早衰老
Aaron Z Wagen, FRACP,William Coath, MSc,Ashvini Keshavan,PhD,et al. Life course, genetic,and neuropathological associations with brain age in the British 1946 birth cohort: a population-based study,The Lancet Healthy Longevity (2022).
doi:10.1016/S2666-7568(22)00167-2
近日,一篇发表在国际杂志The Lancet Healthy Longevity上题为“Life course, genetic, and neuropathological associations with brain age in the 1946 British Birth Cohort: a population-based study”的研究报告中,来自伦敦女王大学学院等机构的科学家们通过研究利用机器学习技术来从MRI扫描中评估人们的大脑年龄,从而识别出了人类机体大脑过早衰老的多种风险因素。
研究者发现,36岁时较差的心血管健康或预示着个体晚年时大脑会更加衰老,而且男性也更倾向于比同龄女性的大脑年龄更大。较高的大脑年龄往往与个体认知测试成绩较差直接相关,而且其还预示着在个体在接下来的两年里大脑萎缩水平的增加,也表明了其或许能成为指示个体认知功能下降或其它与大脑相关的疾病风险的重要临床标志物。
研究者Jonathan Schott说道,我们发现,尽管本文研究中的参与者的实际年龄都非常相似,但使用计算机模型所预测的参与者的大脑年龄或许存在着非常大的差异,我们希望未来有一天其能作为一种有用的工具来帮助识别出机体衰老加速风险的人群,以便其能被提供早期且有针对性的预防性策略,从而来改善其大脑健康。文章中,研究人员应用已经建立的基于MRI的机器学习模型来评估参与者的大脑年龄,随后研究人员比较了参与者目前的大脑年龄,并与整个生命过程中的多种因素进行比较。本文中的参与者年龄在69-72岁之间,其大脑的评估年龄在46-93岁之间,研究人员通过回顾参与者整个生命过程中的多种因素,能够解释大约三分之一的大脑年龄的变化和差异。
综上,本文研究结果表明,大脑-预测的年龄差异或许与机体的心血管疾病风险、神经变性的成像和生化标志物直接相关,相关研究结果也支持,大脑-预测的年龄差异或许能作为大脑健康的综合总结性指标,同时还能反映病理性大脑衰老所产生的多种贡献,同时具有一定的预后效用。
【6】Nat Commun:一组新的基因或能帮助识别衰老细胞并预测跨组织的衰老相关途径
Dominik Saul,Robyn Laura Kosinsky,Elizabeth J Atkinson,et al. A new gene set identifies senescent cells and predicts senescence-associated pathways across tissues. Nat Commun. 2022 Aug 16;13(1):4827. doi:10.1038/s41467-022-32552-1.
细胞衰老现在被认为是动物和人类衰老的基本机制。DNA损伤和/或其他细胞应激源的积累导致增殖以及终末分化、不分裂的细胞经历衰老。衰老细胞的特征包括染色质和分泌体的深刻变化,以及一些衰老标记物的表达增加,包括CDKN2a/p16INK4a和CDKN1a/p21Cip1,免疫逃避和抗凋亡。尽管细胞衰老通过衰老相关的分泌表型导致多种与年龄相关的共病,但体内衰老细胞的鉴定仍然具有挑战性。
近日,一篇发表在国际杂志Nature Communications上题为“A new gene set identifies senescent cells and predicts senescence-associated pathways across tissues”的研究报告中,来自来自梅奥诊所等机构的科学家们通过研究发现,SenMayo或是一个具有潜在临床应用价值的监测衰老的基因集。尽管细胞衰老通过衰老相关的分泌表型导致多种与年龄相关的共病,但体内衰老细胞的鉴定仍然具有挑战性。在本研究中,研究者证实了一个基因组(SenMayo),并在两个老年人类队列的骨活检中验证了它的富集性。
研究者进一步证明了在小鼠衰老细胞遗传清除后骨骼中SenMayo的减少,以及药物衰老细胞清除后人类脂肪组织中SenMayo的减少。接下来,研究者使用SenMayo在单细胞水平上从人和小鼠骨髓/骨scRNA-seq数据中识别衰老的造血细胞或间充质细胞。因此,SenMayo高保真地识别跨组织和物种的衰老细胞。使用这个衰老面板,研究者能够在单个细胞水平上描述衰老细胞的特征,并确定关键的细胞间信号通路。
【7】Nat Commun:识别出一种能将机体衰老与特发性肺纤维化联系起来的特殊蛋白
Caporarello,N.,Lee,J.,Pham,T.X. et al. Dysfunctional ERG signaling drives pulmonary vascular aging and persistent fibrosis. Nat Commun 13,4170 (2022). doi:10.1038/s41467-022-31890-4
特发性肺纤维化(IPF,Idiopathic pulmonary fibrosis)是一种由肺部进行性疤痕所引起的年龄相关的疾病,其会导致患者呼吸衰竭及死亡。目前治疗特发性肺纤维化的疗法非常有限,这就使得科学家们对引起这种疾病背后相关机制的研究成为优先事项。近日,一篇发表在国际杂志Nature Communications上题为“Dysfunctional ERG signaling drives pulmonary vascular aging and persistent fibrosis”的研究报告中,来自波士顿大学等机构的科学家们通过研究发现了一种新型机制,其或能将机体血管的老化与肺部纤维化的发生联系起来。
具体而言,研究者发现,名为ERG的特殊蛋白或参与到了特发性肺纤维化的发生过程中去,EGR在正常情况下能控制内皮细胞(血管的内衬)的再生特性。研究者Maria Trojanowska博士说道,尽管特发性肺纤维化患者的肺部会表现出多种血管异常,但这些改变对特发性肺纤维化的进展在很大程度上并不清楚。本文研究揭示了肺部血管的衰老对特发性肺纤维化病理学机制的影响。此外,本文研究也与人类其他纤维化疾病的发生有关,包括与硬皮病相关的肺纤维化等。
研究人员利用特发性肺纤维化实验模型、人类肺部细胞和来自特发性肺纤维化患者的肺部组织进行研究来调查年龄相关的肺部血管的功能障碍如何导致特发性肺纤维化的进展。此外,研究人员还开发了一种新型模型,即从血管中剔除ERG基因,当肺部发生损伤时,ERG被剔除的模型就不再能够从损伤中进行适当修复了,这种损伤会导致在老年小鼠和特发性肺纤维化患者中观察到的进行性的肺部疤痕。此外,即使在没有损伤的情况下,没有ERG的模型也会表现出晚期衰老的特征,包括炎症水平增加和进展为慢性疾病的更大倾向,这些都是在老年人中经常能够观察到的。 综上,本文研究结果表明,肺部内皮细胞染色质的重塑或许会随着机体衰老而不断恶化,从而导致细胞的异常转录、血管损伤未能及时修复以及损伤后的肺部持续纤维化的表现等。
【8】Nat Struct & Mol Biol:首次发现端粒氧化损伤可以触发细胞衰老
Ryan P Barnes, Mariarosaria de Rosa, Sanjana A Thosar,et al. Telomeric 8-oxo-guanine drives rapid premature senescence in the absence of telomere shortening. Nature Structural & Molecular Biology (2022),doi:10.1038/s41594-022-00790-y.
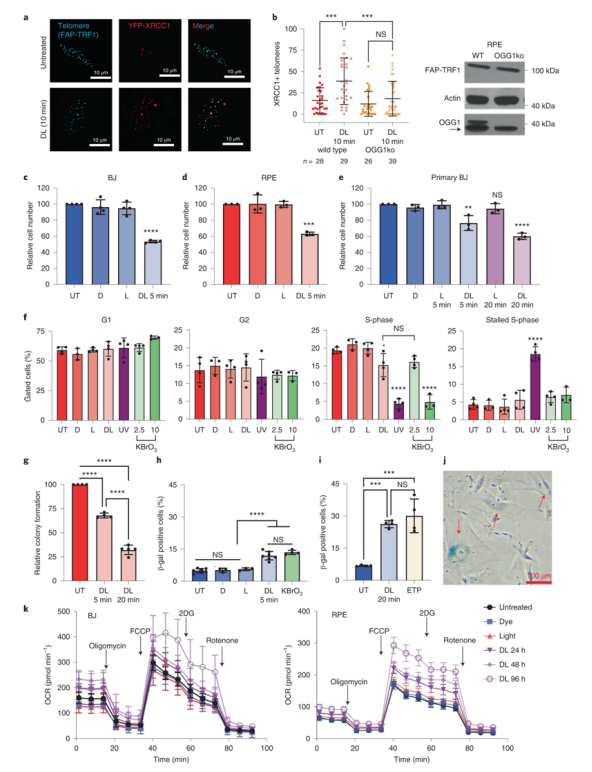
衰老细胞(那些已经失去分裂能力的细胞)随着年龄的增长而累积,是与年龄有关的疾病的关键驱动因素,如癌症、痴呆症和心血管疾病。近日,一篇发表在国际杂志Nature Structural & Molecular Biology上题为“Telomeric 8-oxo-guanine drives rapid premature senescence in the absence of telomere shortening”的研究报告中,来自匹兹堡大学和UPMC希尔曼癌症中心的研究人员发现了一种衰老细胞(也称为僵尸细胞)的产生机制。他们首次发现,端粒的氧化损伤可以触发细胞衰老,这些发现最终可能指向促进健康衰老或对抗癌症的新疗法。
急性端粒8oxoG引发快速过早衰老
图片来源:Nature Structural & Molecular Biology, 2022, doi:10.1038/s41594-022-00790-y。
研究者Patricia Opresko博士表示,僵尸细胞仍然活着,但它们不能分裂,所以它们不能帮助补充组织。虽然‘僵尸细胞’不能正常发挥作用,但它们不是‘沙发土豆’---它们积极分泌化学物质,促进炎症和损害邻近的细胞。我们的研究有助于回答两个大问题:衰老细胞如何随着年龄的增长而积累,以及端粒又如何促成这一过程?”
当一个健康的人体细胞分裂形成两个相同的子细胞时,每条染色体的末端都被去掉一小块DNA,因此端粒随着每次分裂而逐渐变短。然而,目前仍不清楚在人的一生中,细胞是否会频繁分裂,导致它的端粒完全被侵蚀,从而转变为僵尸样状态。几十年来,科学家们已知端粒缩短会在实验室生长的细胞中引发衰老,但他们只能假设端粒的DNA损伤会使细胞进入僵尸状态。如今现在我们了解了这一机制,我们可以开始测试干预措施以防止衰老。例如,也许有办法让抗氧化剂靶向端粒,以保护它们免受氧化损伤。”
这些发现也可以为开发新的药物提供参考,这些药物被称为senolytics(衰老细胞裂解药物),它们可以靶向僵尸细胞并杀死它们。他补充说,“通过减少导致退行性疾病的僵尸细胞的积累,我们也许能够提高‘健康寿命(healthspan)’,即一个人保持健康的时间长度。”
【9】Science:对爬行动物和两栖动物衰老和长寿的最大规模研究揭示了衰老的秘密
BETH A. REINKE,HUGO CAYUELA,FREDRIC J. JANZENX,et al. Diverse aging rates in ectothermic tetrapods provide insights for the evolution of aging and longevity. Science,2022, doi:10.1126/science.abm0151.
190岁的乔纳森-塞舌尔巨龟最近因成为“世界上最长寿的陆地动物”而成为新闻。虽然,像这样的坊间证据存在,即某些种类的龟和其他冷血动物活了很长时间,但证据是零星的,而且大多集中在生活在动物园的动物或生活在野外的少数个体。近日,一篇发表在国际杂志Science上题为“Diverse aging rates in ectothermic tetrapods provide insights for the evolution of aging and longevity”的研究报告中,来自美国宾夕法尼亚州立大学等研究机构的研究人员报告了迄今为止对衰老和长寿的最全面的研究,包括从全世界77种爬行动物和两栖动物的107个种群中野外收集的数据。
在这些作者报告的许多发现中,他们首次记录了海龟、鳄鱼和蝾螈具有特别低的衰老率,并且就其体型而言,具有更长的寿命。他们还发现,保护性表型,比如大多数海龟类的硬壳,有助于减缓衰老,在某些情况下甚至是“可忽略的衰老”,或者说缺乏生物衰老。研究者David Miller表示,有传闻说一些爬行动物和两栖动物衰老缓慢,寿命很长,但直到现在还没有人在野外的众多物种中大规模地研究这个问题。如果我们能了解是什么让一些动物衰老得更慢,我们就能更好地了解人类的衰老,我们也能为爬行动物和两栖动物的保护策略提供信息,因为其中的许多动物都受到威胁或濒临灭绝。”
在这项新的研究中,这些作者将能够调查生物进化的比较系统发育方法应用于捕获动物、标记它们、将它们释放回野外并进行观察所获得的标记-重捕数据。他们的目标是分析与温血动物相比,冷血动物在野外的衰老和寿命的变化,并探索以前与衰老有关的假设--包括体温调节方式和保护性身体特征的存在或缺失。
研究者表示,体温调节模式假说”表明冷血动物---因为它们需要外部温度来调节它们的体温,因此通常具有较低的代谢---比温血动物衰老得更慢,温血动物在身体内部产生自己的热量,具有较高的代谢。
人们倾向于认为小鼠衰老快是因为它们的代谢高,而乌龟衰老慢是因为它们的代谢低,然而,这些作者的发现显示冷血动物的衰老率和寿命范围有的远高于有的远低于相同体型的恒温动物的已知衰老率和寿命,这表明一种动物调节其温度的方式---不论是冷血动物还是温血动物---并不一定表明其衰老率或寿命。研究者Miller指出,我们没有发现支持这样的观点,即较低的代谢率意味着冷血动物的衰老率较慢。这种关系只适用于龟类,这表明龟类在冷血动物中是独一无二的。
【10】Nature:科学家揭示人类机体衰老背后的细胞奥秘
Mitchell, E.,Spencer Chapman,M.,Williams,N. et al. Clonal dynamics of haematopoiesis across the human lifespan. Nature (2022). doi:10.1038/s41586-022-04786-y
近日,一篇发表在国际杂志Nature上题为“Clonal dynamics of haematopoiesis across the human lifespan”的研究报告中,来自Wellcome Sanger研究所等机构的科学家们通过研究发现,个体在一生中在血液干细胞中缓慢积累的遗传改变很有可能是引发其70岁后造血功能发生巨大变化的原因,相关研究提出了一种关于人类衰老的新型理论。
所有的人类细胞在个体一生中都会获得一定的遗传改变,即所谓的体细胞突变,衰老很可能就是随着时间延续机体细胞发生多种类型的损伤以及损伤的积累引起的一种状态,其中一种理论认为,体细胞突变的积累会促进细胞逐渐失去功能性的储备,然而,目前研究人员并不清楚这种逐渐积累的分子损伤是如何转化为机体在70岁后器官功能发生突然恶化的。
为了调查人类机体的衰老过程,研究人员对来自机体骨髓中的徐细胞的产生进行了研究,并分析了10名年龄从新生儿到老年人的个体,共对3579个造血干细胞进行了全基因组测序分析,并识别出了每个细胞中所包含的所有体细胞突变,同时研究人员还利用这一点来重建每名个体血液干细胞中的“家族树”,并首次揭示了血细胞之间的无偏见观点,以及这些关联在个体一生中是如何发生改变的。
研究人员发现,这些“家族树”在个体70岁后会发生剧烈变化,65岁以下的成年人机体的血细胞产生自2万只10万个干细胞,每个干细胞的贡献量都大致相同;相比之下,70岁以上的个体机体的血液产生则非常不平等,在每个被研究的老年人中,一组会减少扩大的干细胞克隆(仅有10至20个),而其贡献了所有造血量的一半以上,这些高度活跃的干细胞在人类医生中会逐渐扩大,并由罕见的名为“驱动突变”的体细胞突变子集所引发。
综上,本文研究结果首次揭示了在个体一生中稳步积累的突变如何引发其在70岁后发生血细胞群的灾难性和不可逆转的改变,这一研究结果或许适用于机体很多器官系统,这种携带突变的克隆或许还会在机体其它许多组织中随着年龄增长而不断扩大,同时这或许会增加个体患癌的风险,也会促进机体与衰老相关的其它功能性改变。
【11】Science:揭示衰老的神经系统在遭受损伤后再生能力下降机制
Luming Zhou, Guiping Kong, Ilaria Palmisano, et al. Reversible CD8 T cell–neuron cross-talk causes aging-dependent neuronal regenerative decline. Science (2022),doi:10.1126/science.abd5926.
轴突再生和神经功能的恢复在老年人中极为有限。因此,神经系统受伤后通常会出现严重和长期的残疾。科学家们对因衰老出现再生失败的分子机制了解不多,阻碍了在开发有效的神经系统修复疗法方面取得进展。为了促进神经系统修复策略的设计,人们迫切需要确定导致因衰老出现再生失败的关键分子机制和细胞机制。
衰老会导致细胞信号传导的广泛改变,包括代谢、免疫和整体组织平衡的变化,这在神经系统的生理学特性和损伤反应中起着关键作用。近日,一篇发表在国际杂志Science上题为“Reversible CD8 T cell–neuron cross-talk causes aging-dependent neuronal regenerative decline”的研究报告中,来自英国帝国理工学院的研究人员推测衰老的神经系统在受伤后会出现独特的分子和细胞修饰,这将有助于促进因衰老而出现的再生能力下降。为此,他们通过对年轻小鼠和年老小鼠坐骨神经损伤的成熟模型中的背根神经节(dorsal root ganglia, DRG)进行RNA测序,系统性地研究了与衰老和神经系统损伤有关的分子和细胞特征。对这些机制的深入了解可能发现以前没有认识到的分子靶标,以对抗因衰老而出现的再生能力下降。
对RNA测序数据的初步分析发现,衰老主要与小鼠坐骨神经损伤后DRG中T细胞激活和信号传导的明显增加有关。随后的实验表明,衰老与坐骨神经损伤前后DRG中包括淋巴毒素在内的炎性细胞因子的增加有关。具体来说,这些作者发现淋巴毒素β是NF-κB磷酸化所必需的,NF-κB磷酸化驱动趋化因子CXCL13在DRG感觉神经元中的表达。在坐骨神经损伤后,CXCL13在通过过表达主要组织相容性复合物I型(MHC I)作为抗原呈递细胞发挥作用的神经元附近吸引了表达CXCL13受体CXCR5的CD8+ T细胞。CXCR5+CD8+T细胞与表达MHC I的感觉神经元的结合激活了caspase 3,而激活的caspase 3破坏了pAKT和pS6信号传导,从而导致再生失败。利用药物拮抗caspase 3激活可以逆转年老小鼠的再生失败,并恢复pAKT和pS6的表达。
综上,这些作者鉴定出一种衰老依赖性机制,该机制基于CXCL13依赖性地招募和激活感觉神经元附近的CXCR5+CD8+T细胞,这些T细胞在与呈递MHC I的DRG神经元沟通后限制了神经损伤后的轴突再生。用人源化单克隆抗体中和CXCL13可以逆转再生能力的下降,并促进年老小鼠的神经系统恢复,这表明一种可能在未来疗法中使用的途径。
【12】Nature:药物BGE-175逆转免疫衰老 有望阻止老年人死于COVID-19
Lok-Yin Roy Wong,Jian Zheng1 na1,Kevin Wilhelmsen, et al. Eicosanoid signaling blockade protects middle-aged mice from severe COVID-19. Nature, 2022, doi:10.1038/s41586-022-04630-3.
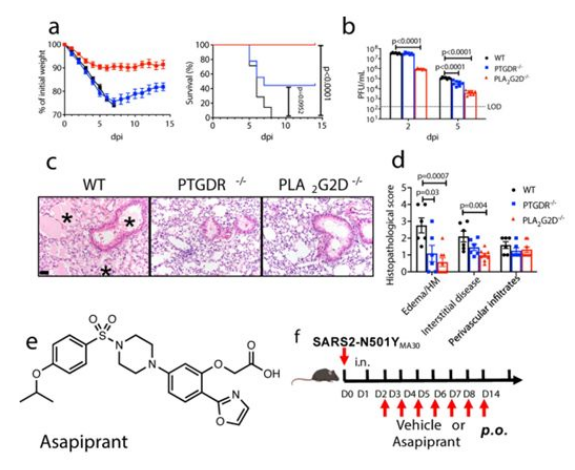
免疫系统随着年龄的增长而退化,使COVID-19在老年人中特别致命,但迄今为止,没有任何临床可用的药物能解决这一关键风险因素。近日,一篇发表在国际杂志Nature上题为“Eicosanoid signaling blockade protects middle-aged mice from severe COVID-19”的研究报告中,来自美国爱荷华大学等研究机构的研究人员发现一种能逆转免疫衰老(immune aging)的多个方面的口服药物(BGE-175(asapiprant))能有效防止COVID-19小鼠模型的死亡,这表明该药物有可能用于保护在COVID-19大流行病中风险最大的老年患者。
图片来源:Nature, 2022, doi:10.1038/s41586-022-04630-3
在这项新的研究中,每日剂量的BGE-175(asapiprant)保护老年小鼠免受致命剂量的SARS-CoV-2,即导致COVID-19的冠状病毒。90%接受这种药物治疗的小鼠存活下来,而所有未接受治疗的对照组小鼠则死亡。BGE-175治疗是在感染两天后开始的,当时这些小鼠已经生病,这个时间范围与现实生活中的临床情况有关,患者只有在出现症状后才会接受药物治疗。这项研究中使用的小鼠模型密切反映了人类COVID-19的病理进展情况。这些作者构建出的SARS-CoV-2小鼠适应毒株引起的疾病具有人类COVID-19的许多特征:肺部气囊积液,免疫细胞广泛浸润肺部组织,以及高水平的促炎性细胞因子。
BGE-175目前正处于2期临床试验中,以测试它是否能防止因COVID-19住院的老年患者的疾病进展和死亡。BGE-175正在由BioAge实验室进行临床开发。BioAge实验室是一家位于加州的生物技术公司,致力于通过靶向衰老的分子机制来开发治疗人类疾病和延长健康寿命的药物。COVID-19大流行病已经摧毁了世界各地的老年人口。这篇论文中有希望的临床前数据显示,在一种令人信服的人类COVID-19模型中,BGE-175几乎完全保护老年小鼠免于死亡。通过逆转与年龄相关的关键免疫机制的衰退,BGE-175可能使老年患者更有效地抵抗这种疾病。”
【13】Aging Cell:纠正细胞中线粒体的功能或能预防机体衰老过程中肌肉的损失
Andrea Irazoki,Marta Martinez-Vicente,Pilar Aparicio,et al. Coordination of mitochondrial and lysosomal homeostasis mitigates inflammation and muscle atrophy during aging,Aging Cell (2022). doi:10.1111/acel.13583
衰老过程中肌肉质量和力量的丧失被称为“肌肉减少症”(sarcopenia),其影响着老年人群,同时该疾病也是一种机体退化的过程,常常会给患者带来福祉的减少以及对他人依赖性的增加;如今越来越多的研究证据表明,这种形式的肌肉萎缩症与机体的慢性炎症有关,但炎症是何时以及如何发生的,研究人员或许并不清楚。
近日,一篇发表在国际杂志Aging Cell上题为“Coordination of mitochondrial and lysosomal homeostasis mitigates inflammation and muscle atrophy during aging”的研究报告中,来自西班牙巴塞罗那科学技术学院等机构的科学家们通过研究发现,促进肌肉萎缩症的炎性过程或许与细胞中损伤线粒体的积累有关,同时研究人员还描述了与受损线粒体清除相关的BNIP3蛋白的水平增加如何更好地与肌肉衰老直接相关。
研究者David Sebastián说道,如果BNIP3的水平在老龄人群机体中较低时,就会有更多的损伤线粒体积累并诱发机体的炎性过程,从而就会引发肌肉萎缩症发生;目前研究人员并不清楚为何有些人群机体中的BNIP3水平较高,而其他人机体中BNIP3的水平较低。这项研究中,研究人员利用培养的细胞、小鼠模型以及来自年轻人和老年人机体中的样本进行了相关研究。
作为细胞中的能量工厂,线粒体对于机体健康至关重要;因此细胞就必须确保这些细胞器处于良好的状态,随着机体线粒体的衰老,其就不再会正常发挥作用了,此时机体就会通过一种线粒体自噬的过程来移除或回收损伤或衰老的线粒体。随着机体年龄增长,这个过程或许就变得不那么有效了,缺陷的线粒体就会趋于开始积累,研究者考虑到,这一点或许能通过BNIP3水平的增加来进行补充,从而就会刺激线粒体自噬,除了能与线粒体膜结合来移除这些细胞器外,BNIP3还会影响溶酶体的功能,而溶酶体对于移除细胞中受损的组分非常重要。
综上,本文研究结果表明,本文研究数据或能帮助揭示一种涉及有丝分裂蛋白BNIP3的新型适应性机制,其或能将线粒体和溶酶体的平衡与炎症联系起来,并能作为维持机体衰老过程中肌肉健康的关键。
【14】Nat Aging:细胞再生疗法可以安全地逆转小鼠衰老
Browder,K.C.,Reddy,P.,Yamamoto,M. et al. In vivo partial reprogramming alters age-associated molecular changes during physiological aging in mice. Nat Aging,243–253 (2022). doi:10.1038/s43587-022-00183-2
年龄可能只是一个数字,但这个数字往往会带来一些不必要的副作用,从骨质疏松、肌肉变弱到心血管疾病和癌症的风险增加。近日,一篇发表在国际杂志Nature Aging上题为“In vivo partial reprogramming alters age-associated molecular changes during physiological aging in mice”的研究报告中,来自美国沙克生物研究所和Genentech公司的研究人员证实他们可以通过将中老年小鼠的细胞部分地重置到更年轻的状态,安全有效地逆转它们的衰老过程。
研究者Juan Carlos Izpisua Belmonte教授表示,我们很高兴,我们可以在整个生命周期中使用这种方法来减缓正常动物的衰老。该技术在小鼠身上既安全又有效。除了解决与年龄有关的疾病,这种方法可能为生物医学界提供一种新的工具,通过改善不同疾病情况(比如神经退行性疾病)下的细胞功能和弹性来恢复组织和机体健康。
随着有机体的衰老,改变的不仅仅是它们的外在形象和健康;它们体内的每一个细胞都带有一个记录时间流逝的分子钟。与年轻人或年轻动物相比,从老年人或老年动物身上分离出来的细胞在其DNA上有不同的化学模式,称为表观遗传标记。科学家们知道,在成体细胞中加入四种重编程分子---Oct4、Sox2、KLF4和cMyc(也被称为“山中因子”)---的混合物,可以将这些表观遗传标记重置为其原始模式。这种方法让人们将成体细胞的发育时钟拨回,变成诱导性多能干细胞(ips)。
在这项新的研究中,Izpisua Belmonte和他的同事们在健康动物的衰老过程中测试了这种细胞再生方法的改进形式。一组小鼠从15个月大到22个月大(大约相当于人类的50至70岁)时接受定期剂量的山中因子。另一组小鼠从12个月大至22个月大(大约相当于人类的35至70岁)时接受定期剂量的山中因子。第三组小鼠在25个月大(大约相当于人类的80岁)时接受定期剂量的山中因子,为期仅一个月。
研究者Pradeep Reddy指出,我们真正想确定的是,在更长的时间跨度内使用这种方法是安全的。的确,我们没有观察到对这些动物的健康、行为或体重有任何负面影响。与对照组小鼠相比,接受了山中因子的小鼠没有出现血细胞改变或神经系统的变化。此外,这些作者在任何一组动物中都没有发现癌症。
【15】Nature:衰老的“罪魁祸首”竟是核糖体?
Stein,K.C.,Morales-Polanco,F.,van der Lienden,J. et al. Ageing exacerbates ribosome pausing to disrupt cotranslational proteostasis. Nature 601,637–642 (2022).
doi:10.1038/s41586-021-04295-4
衰老是每个人都无法避免的“宿命”,它通常伴随着细胞适应性的下降以及蛋白质功能的丧失。许多与“衰老”相关的疾病(比如阿尔茨海默症和帕金森)都是由蛋白质聚集(protein aggregation)所引起的,而“蛋白质聚集”则是蛋白质错误折叠的结果。为了打开这一“黑匣子”,美国斯坦福大学(Stanford University)的研究团队将目光聚焦于细胞内蛋白质的“合成机器”—核糖体(ribosome),并假设衰老过程中蛋白质翻译效率的改变可能与蛋白质稳态的崩溃有关,即将“衰老如何导致蛋白质聚集”这一问题追溯到核糖体产生新生蛋白时的年龄依赖性损伤(age-dependent impairment)——简单地说,就是年龄是如何影响核糖体功能的。
相关研究成果“Ageing exacerbates ribosome pausing to disrupt cotranslational proteostasis”发表在国际杂志Nature上。研究者认为,造成该现象的原因是由于核糖体“消极怠工”,令产生蛋白质的细胞装配“流水线”减慢或停滞,从而引发一系列的“滚雪球效应”,导致错误折叠的蛋白质越来越多,细胞功能由此受损。我们都知道,只有肽链折叠正确,蛋白质才能正常发挥其功能,并在细胞环境中保持可溶性;相反,错误折叠的蛋白质往往会相互粘连,这不仅会导致其功能失效,还会产生有毒的聚集物。
该研究提出,随着细胞的衰老,核糖体的翻译“暂停”情况将不断增加,导致核糖体相关质量控制(ribosome-associated quality control,RQC)超负荷运行、新生多肽聚集,从而加剧蛋白平衡障碍和衰退情况。新生多肽对蛋白平衡网络来说其实是一个巨大的负担,与成熟蛋白相比,新生多肽的亚稳定性使其更容易发生错误折叠。
研究者Judith Frydman博士表示,蛋白质形成的阶段,是其生命中最脆弱和最关键的时刻。但恰恰也是这个阶段,是其最容易发生错误折叠的时候。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


