《自然·免疫学》:CAR-巨噬细胞重大升级!浙大团队开发出能杀伤、能保持抗肿瘤极性的第二代CAR-巨噬细胞
来源:奇点糕 2024-01-23 10:27
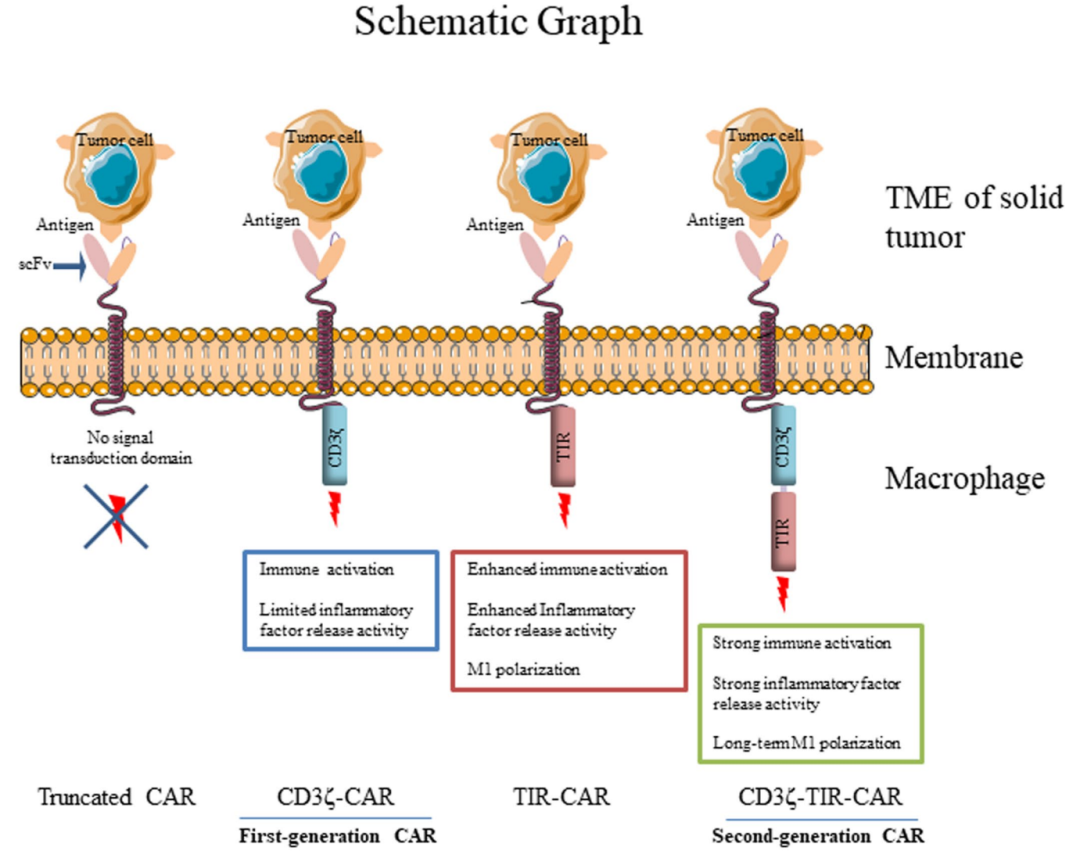
研究团队将TIR与CD3ζ整合到一起,构建第二代巨噬细胞特异性嵌合抗原受体(M-CAR),命名为CD3ζ-TIR-CAR。
巨噬细胞隶属于先天免疫系统,是免疫第一道防线重要成员,它们不仅能亲自消灭病原体或异常细胞,还能呈递抗原激活其它免疫细胞。于是,浙江大学的张进等人以CD3ζ作为CAR的胞内结构域,为巨噬细胞进行“升级”,使其能够以抗原依赖性方式吞噬肿瘤细胞,于2020首次报道了CAR-巨噬细胞[1]。
在此之后,张进等人进一步对其改良得到第二代CAR-巨噬细胞,研究成果于近日发表在《自然·免疫学》期刊上[2]。
他们将激活吞噬效应的CD3ζ结构域与调控巨噬细胞极性的TIL结构域串联在一起,组成巨噬细胞特异性嵌合抗原受体(M-CAR)的胞内结构,进一步得到第二代诱导多能干细胞来源的工程化CAR-巨噬细胞(CAR-iMAC)。
与第一代相比,第二代CAR-iMAC吞噬功能更强,并能够维持抗肿瘤表型,单独治疗或与CD47抗体联合治疗在实体瘤小鼠模型中具有良好疗效,通过胞葬方式消除肿瘤细胞。
浙江大学的雷安华和余华(现为南昌大学特聘教授)是文章的共同第一作者。

论文首页截图
说起来,在第一代CAR-巨噬细胞中负责激活吞噬效应的CAR结构域CD3ζ,其实是从CAR-T细胞“借”来的,并非专为巨噬细胞量身定制。
不同于T细胞,巨噬细胞的“性格”有些摇摆不定。在趋化因子、化学信号等严格调控下,巨噬细胞可分化为M1、M2两个主要表型,M1型具有较高的抗肿瘤、抗病原能力,吞噬活性、促炎活性、抗原呈递功能更强;M2型则起到抗炎作用,参与组织重塑、愈合和促进肿瘤生长,与肿瘤进展和免疫抑制相关。M1型与M2型之间的转换是可逆的,中间存在过渡态。
第一代CAR-巨噬细胞正是栽在了巨噬细胞的性格多变上,虽然手持利刃,但进了实体瘤里还是难逃被肿瘤微环境诱拐的命运,分化成为促肿瘤的M2型肿瘤相关巨噬细胞。所以说,还是得打造适合巨噬细胞的专用武器才行。
Toll样受体4 (TLR4)为研究者们提供了扭转巨噬细胞“性格”的机会。TLR4在巨噬细胞表面广泛表达,识别到脂多糖后,其胞内的TIR结构域会触发下游信号传递,通过激活NF-κB通路促进巨噬细胞向M1样的促炎状态极化,抑制M2表型。
因此,在此次优化中,研究团队将TIR与CD3ζ整合到一起,构建第二代巨噬细胞特异性嵌合抗原受体(M-CAR),命名为CD3ζ-TIR-CAR。
研发思路
CD3ζ-TIR-CAR相当于是CD3ζ和TIR串联在一起组成CAR的胞内结构域。基于CD3ζ-TIR-CAR,研究团队使用其成熟的iPSC分化巨噬细胞(iMAC)平台和基因工程技术,得到了第二代诱导多能干细胞来源的工程化CAR-巨噬细胞(CAR-iMAC)。
结果显示,相比于CD3ζ-CAR,CD3ζ-TIR-CAR这种串联方式可以进一步增强CAR-iMAC对肿瘤细胞的细胞毒活性,并维持CAR-iMACs的M1型极化状态,提高其抗原提呈能力,显示出更高的IFN-γ反应水平和更低的氧化磷酸化水平。从单细胞RNA测序结果来看,第二代CAR-iMAC的M1样基因表达提高,M2样基因表达被抑制。
在胶质母细胞瘤小鼠模型中,第二代CAR-iMAC能够显著小鼠的颅内肿瘤进展,并延长荷瘤小鼠存活期。在肝细胞癌小鼠模型中,接受第二代CAR-iMAC治疗的8只小鼠中有6只达到完全缓解。
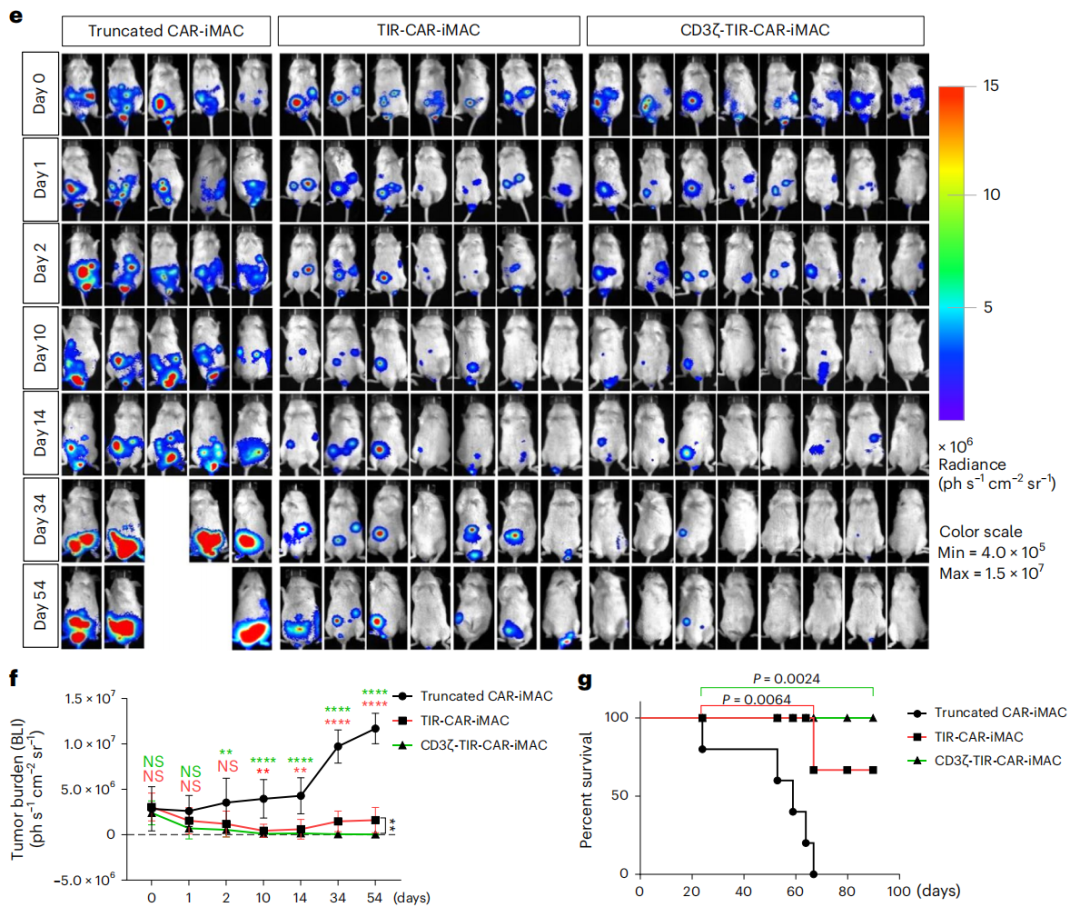
第二代CAR-iMAC的实体瘤疗效
不仅如此,第二代CAR-iMAC治疗后,除了M1型巨噬细胞,肿瘤组织中的T细胞和NK细胞数目也明显增加,树突状细胞则没有,说明第二代CAR-iMAC能够明显改善抑制性肿瘤免疫微环境。肝细胞癌小鼠实验也证明这一点,第二代CAR-iMAC与CD47抗体的组合具有协同效应,仅需低剂量CD47抗体即可取得更优的抗肿瘤效果,联合治疗后10天所有肝细胞癌小鼠表现出显著缓解,30天时肿瘤几乎完全消退。
另外,小鼠实验证明了第二代CAR-iMAC治疗的安全性。值得注意的是,尽管第二代CAR-iMAC治疗会引起IL-6、IL-1等细胞因子水平升高,但没有在小鼠实验中观察到细胞因子释放综合征,这需要在其它人源化模型中进行更多验证。
最后,研究团队探索和完善描述第二代CAR-iMAC抗实体瘤的机制,揭示其以胞葬形式清除肿瘤细胞:肿瘤细胞抗原和CAR的胞外结构域结合后激活胞内串联在一起的CD3ζ、TIR结构域,诱导M1型极化和肿瘤坏死因子的分泌,从而诱导肿瘤细胞凋亡,巨噬细胞再通过胞饮作用吞噬和消化肿瘤细胞的凋亡残体。
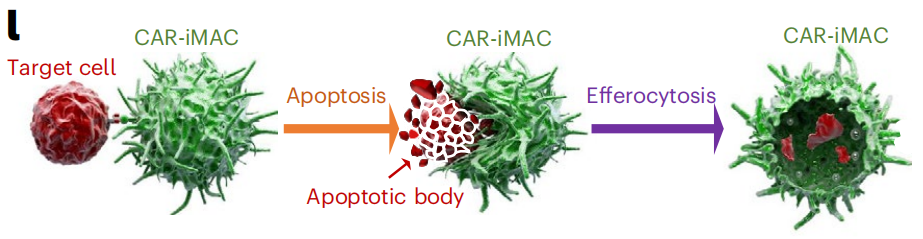
CAR-iMAC通过胞葬形式清除肿瘤细胞
目前,CAR-T细胞在血液肿瘤的效果已经得到证实,而面对实体瘤仍是心有余而力不足,部分可归因于免疫抑制性的肿瘤微环境。越来越多的研究表明,实体瘤组织中免疫细胞主要成员、具有极性的巨噬细胞,是解决实体瘤免疫治疗耐药的突破口。
首个CAR-巨噬细胞用于治疗实体瘤的临床试验已经开启[3],张进等人更是在这项研究中进行优化,开发出第二代CAR-巨噬细胞,为癌症免疫治疗提供极具潜力的新策略。
参考文献:
[1]Zhang, L., Tian, L., Dai, X. et al. Pluripotent stem cell-derived CAR-macrophage cells with antigen-dependent anti-cancer cell functions. J Hematol Oncol 13, 153 (2020). https://doi.org/10.1186/s13045-020-00983-2
[2]https://www.nature.com/articles/s41590-023-01687-8
[3]Chen, Y. et al. CAR-macrophage: a new immunotherapy candidate against solid tumors. Biomed. Pharmacother. 139,111605 (2021).
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


