科研人员研发脂质体纳米药物用于乳腺癌的光动力/免疫联合治疗
来源:网络 2023-05-08 11:49
本研究聚焦肿瘤免疫治疗前沿,利用纳米药物的多药递送及协同治疗优势,创新性地开发了常用抗生素——多西环素的抗肿瘤作用,对于丰富多西环素的临床适用范围具有积极意义。
近日,中山大学附属第三医院纳米医学中心帅心涛教授团队联合超声科任杰教授团队,在生物材料著名期刊Small发表题为“Nanodrug Inducing Autophagy Inhibition and Mitochondria Dysfunction for Potentiating Tumor Photo-Immunotherapy”的研究成果。研究针对肿瘤的低免疫原性及免疫抑制环境限制抗肿瘤免疫治疗效果的主要临床困境,开发了一种脂质体纳米药物,通过联合二氢卟吩e6(Ce6)介导的光动力治疗与盐酸多西环素(Doxy)诱导的自噬抑制和线粒体功能障碍,实现“冷肿瘤”乳腺癌高效的光动力/免疫联合治疗。本研究聚焦肿瘤免疫治疗前沿,利用纳米药物的多药递送及协同治疗优势,创新性地开发了常用抗生素——多西环素的抗肿瘤作用,对于丰富多西环素的临床适用范围具有积极意义。
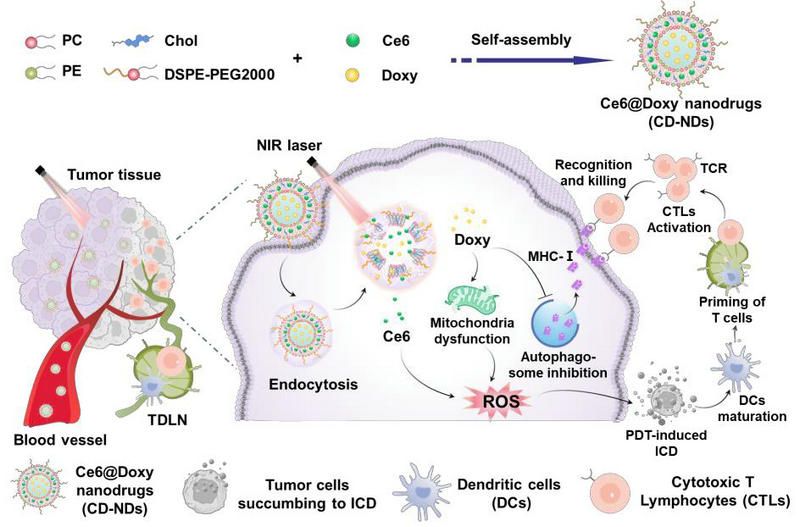
图1、纳米药物诱导自噬抑制和线粒体功能障碍增强肿瘤光动力-免疫治疗的示意图。TDLN,肿瘤引流淋巴结;TCR,T细胞受体。
免疫疗法变革了癌症的治疗方式,并在某些类型的癌症中取得了显著的临床治疗效果,但大多数实体瘤还是存在免疫原性差、抗原呈递缺陷以及细胞毒性T淋巴管(CTL)浸润效率低下等问题。这些肿瘤呈现高度免疫抑制性的肿瘤微环境(TME),对免疫治疗的响应性较低。因此,合理重塑免疫抑制性TME以提高肿瘤免疫治疗的响应率,具有积极的临床研究意义。诱导肿瘤发生免疫原性细胞死亡(ICD)可以通过增加肿瘤抗原暴露和促进树突细胞(DCs)抗原呈递,是重塑免疫抑制TME的有效策略。发生ICD的肿瘤细胞将释放肿瘤相关抗原(TAAs)和损伤相关分子模式(DAMPs),例如三磷酸腺苷(ATP)和高迁移率族蛋白B1(HMGB-1)。这些释放的TAAs和DAMPs可以作为激活DCs成熟以及效应T细胞启动的信号,最终激活一系列抗肿瘤免疫级联反应。
化疗、放疗、光动力治疗(PDT)、光热治疗、声动力治疗和化学动力治疗等多种治疗方式,已被证明是协同增强免疫疗法的有效手段。特别是PDT,其作为一种稳健、无创、低副作用的抗肿瘤治疗方式,已引起了极大的关注。在激光照射下,PDT不仅通过产生丰富的细胞毒性活性氧(ROS),来对癌细胞产生强大的杀伤作用,而且能有效引发抗肿瘤免疫反应。研究表明,ROS不仅可以诱导肿瘤细胞ICD,而且具有再教育免疫细胞的能力。例如,ROS可以将免疫抑制性肿瘤相关巨噬细胞(TAMs)再极化为抗肿瘤的M1型巨噬细胞。然而,PDT的治疗效果会受到肿瘤组织缺氧环境、激光组织穿透深度、ROS较短的半衰期和较短扩散距离、肿瘤异质性以及免疫抑制微环境等因素的限制。因此,单纯的PDT并不能完全根除肿瘤,同时,它诱导的ICD也不足以产生足够的免疫反应来有效地消除残留的肿瘤。
此外,PDT诱导的ICD激活DCs的抗原呈递以及启动效应T细胞后,细胞毒性T淋巴细胞(CTLs)需要表面的T细胞受体(TCR)结合肿瘤细胞表面的主要组织相容性复合物I类(MHC-I)进行肿瘤识别。然而,研究发现多种肿瘤低表达MHC-I且表现出过度的自噬活性。自噬是细胞去除功能损伤或多余成分以维持生理平衡的重要生理活动。肿瘤细胞在遇到代谢应激时,会通过上调自噬活动来抵抗细胞凋亡和坏死。最新研究已证明,肿瘤细胞可以通过自噬活动吞噬MHC-I,将其运到溶酶体进行生物降解,以逃避免疫系统的识别。因此,通过抑制肿瘤细胞的自噬,增加其表面MHC-I的表达,提高T细胞对肿瘤细胞的免疫识别,是提高抗肿瘤免疫治疗的有效途径。
因此,本研究制备了一种脂质体纳米药物,共递送抗生素盐酸多西环素(Doxy)和光敏剂二氢卟吩e6(Ce6),实现肿瘤高效的光动力/免疫联合治疗。Doxy是一种常用抗生素,最新研究发现其还具有抗肿瘤作用。团队的研究进一步发现Doxy可以抑制自噬并诱导线粒体功能障碍。光敏剂Ce6在近红外(NIR)激光照射下,发挥光动力治疗作用,并诱导肿瘤细胞发生ICD,逆转“冷肿瘤”三阴乳腺癌的免疫抑制微环境。而Doxy会诱导线粒体功能障碍,增强光动力治疗效果;同时,Doxy也会抑制肿瘤细胞的自噬活性,从而提高肿瘤细胞表面MHC-I的表达,促进肿瘤抗原的呈递和CTLs的识别,从而提高肿瘤的免疫原性。通过联合Ce6介导的光动力治疗与Doxy诱导的自噬抑制和线粒体功能障碍,实现三阴乳腺癌的高效治疗。本研究所开发的纳米药物显示出良好的抗肿瘤效果,为改善“冷肿瘤”的免疫治疗提供了一种高效的策略。
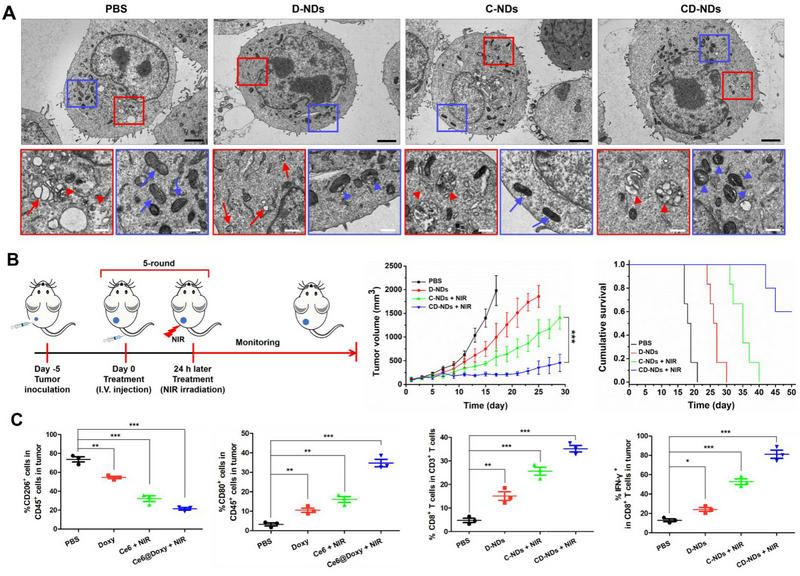
图2、(A)乳腺癌肿瘤细胞接受不同纳米药物处理后的电镜图像。红色线框放大图显示胞内自噬情况,红色实线箭头表示自噬小体,红色箭头表示自噬溶酶体;蓝色线框放大图显示胞内线粒体情况,蓝色实线箭头表示正常线粒体,蓝色箭头表示受损线粒体。(B)纳米药物在乳腺癌肿瘤模型中的治疗方案示意图及不同纳米药物治疗小鼠的平均肿瘤生长曲线和小鼠生存率。(C)通过流式细胞术检测肿瘤组织中的M1型巨噬细胞、TAMs、CTLs和效应T淋巴细胞验证纳米药物治疗后抗肿瘤免疫激活情况。
论文第一作者为中山大学附属第三医院超声科博士后肖洪,通讯作者为中山大学附属第三医院帅心涛教授、任杰教授及珠海市人民医院韩世松副研究员。这一研究属于“老药新用”的典型范例,是基础研究与临床应用的有机结合,推动了医院跨学科研究的发展。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


