10月Nature杂志不得不看的重磅级亮点研究!
来源:生物谷原创 2022-10-27 22:39
时间匆匆易逝,转眼间10月份即将结束,在即将过去的10月里,Nature杂志又有哪些亮点研究值得学习呢?小编对相关文章进行了整理,与大家一起学习!
时间匆匆易逝,转眼间10月份即将结束,在即将过去的10月里,Nature杂志又有哪些亮点研究值得学习呢?小编对相关文章进行了整理,与大家一起学习!
【1】Nature:新研究揭示STING诱导的调节性B细胞破坏NK细胞的功能,有望开发出更有效的癌症免疫疗法
doi:10.1038/s41586-022-05254-3
在一项新的研究中,来自美国北卡罗来纳大学教堂山分校的研究人员发现了一种潜在的方法来克服阻断有效抗癌免疫反应的障碍,从而为在人体内进行更有效的免疫治疗提供了可能性。相关研究结果于2022年10月5日在线发表在Nature期刊上,论文标题为“STING-induced regulatory B cells compromise NK function in cancer immunity”。
肿瘤细胞周围不利的免疫环境是使用免疫疗法治疗许多实体瘤的主要障碍,特别是胰腺癌和乳腺癌,因为这种抑制性的环境可以阻止有助于攻击肿瘤的免疫反应。一种称为STING(STimulator of INterferon Genes)的蛋白有希望有力地触发免疫系统的多个部分并破坏业已建立的障碍。研究者Jenny PY Ting博士说,“尽管激活免疫系统来控制恶性肿瘤已引发了癌症治疗变革,但有相当一部分患者对免疫疗法没有反应。然而,靶向STING的新药物一直是医药开发的重中之重,然而临床试验显示,肿瘤对靶向STING的药物有明显的抵抗性。”
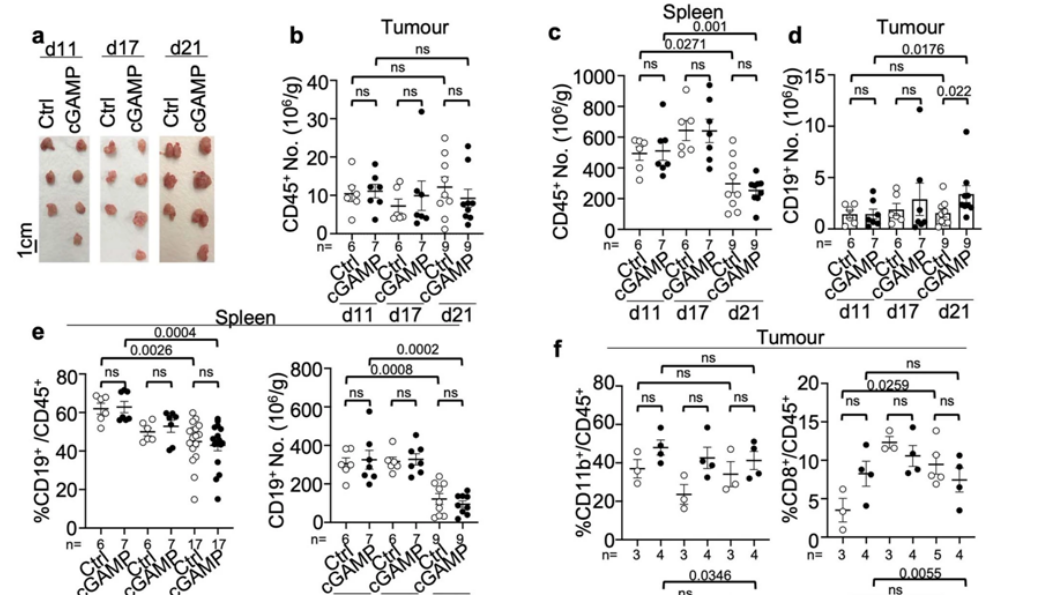
cGAS-STING通路对免疫细胞形态和肿瘤生长的影响。
图片来源:Nature, 2022, doi:10.1038/s41586-022-05254-3。
Ting说,“在临床上,为了提高STING靶向药物的有效性,我们需要更深入地了解这些药物如何影响肿瘤中的不同免疫细胞,因为STING对免疫的有益作用可能会被它的意料之外的免疫抑制作用所抵消。”这些作者主要关注胰腺癌的临床前模型,因为这种疾病的五年生存率只有10%,而且没有什么治疗方案。他们还将这项新的研究扩展到其他实体瘤,包括黑色素瘤、三阴性乳腺癌和肺癌。重要的是,他们在胰腺癌中观察到的情况广泛适用于这些其他癌症。
【2】Nature:首次在活的细菌细胞内部观察抗生素如何发挥作用
doi:10.1038/s41586-022-05255-2
每个活细胞都依赖蛋白来运作,而蛋白的合成过程---翻译---对生存至关重要。细菌也不例外,参与翻译的分子机器是抗生素的最常见作用靶标之一。如今,在一项新的研究中,来自德国海德堡欧洲分子生物学实验室、马克斯-普朗克生物物理化学研究所、柏林工业大学和爱丁堡大学等研究机构的研究人员首次从原子细节上可视化观察了抗生素如何影响细菌细胞内的蛋白生产过程。这项研究也标志着科学家们首次在细胞内直接观察到活跃的翻译复合物(translation machinery)在原子水平上的结构变化,而不是使用试管中的孤立分子。重要的是,这种方法使他们能够确定这这些翻译复合物在细胞内用来相互“交谈”的机制。他们还进行了生物信息学分析,以观察核糖体蛋白的多样性在4000多种代表性细菌中是什么样的。相关研究结果发表在2022年10月6日的Nature期刊上,论文标题为“Visualizing translation dynamics at atomic detail inside a bacterial cell”。
研究者Julia Mahamid及其团队是使用一种叫做低温电子断层扫描(cryo-electron tomography, cryo-ET)的技术研究肺炎支原体细菌的专家。这种引起人类非典型肺炎的微小细菌,尽管只有大约万分之一毫米大小,却有功能齐全的蛋白合成机器。研究者Liang Xue说,“我们选择支原体进行研究,因为它们是最小的活细胞之一,并被广泛用作系统生物学和合成生物学研究中的模型细胞。”
cryo-ET允许科学家们使用电子显微镜对闪冻的生物样本进行连续成像,并将所得到的图像组合起来,形成细胞的三维视图---有点像一台微型磁共振成像机器。Mahamid,“有了来自原始保存的细胞的大规模cryo-ET数据,就有可能捕捉到一种分子机器在发挥作用时不同状态下的高分辨率图片,并将它们组合成一部影片。”当人们看支原体细胞的cryo-ET图片时,最突出的结构之一是微小的黑色斑点--这些是核糖体。Xue说,“核糖体是最古老的大分子机器之一,甚至可能在细胞出现之前就已经存在。”核糖体是参与蛋白翻译的主要分子机器,它们存在于从细菌到人类的所有细胞中。
doi:10.1038/s41586-022-05279-8
人类的大脑很可能是整个生物世界中最复杂的器官,长期以来一直是科学家们着迷的对象。然而,研究大脑,特别是调节和指导它的发育的基因和分子开关,并不是一件容易的事。迄今为止,科学家们一直在使用动物模型(主要是小鼠)进行研究,但他们的发现不能直接适用于人类。小鼠的大脑结构与人类不同,缺乏人类大脑典型的皱褶表面。迄今为止,细胞培养物在这一领域的价值有限,因为细胞在培养皿上生长时往往会扩散到大片区域;这与大脑的自然三维结构不相符。
瑞士苏黎世联邦理工学院生物系统科学与工程系的Barbara Treutlein教授及其团队采取了一种新的方法来研究人类大脑的发育:他们正在培养和使用类器官---毫米大小的可以利用所谓的多能性干细胞培育出的三维组织。只要这些多能性干细胞接受到正确的刺激,他们就能将它们编程成为身体中存在的任何一种细胞,包括神经元。当它们聚集成一个小的组织球,然后暴露在适当的刺激下,它们甚至可以自我组装,形成具有复杂组织结构的三维大脑类器官。
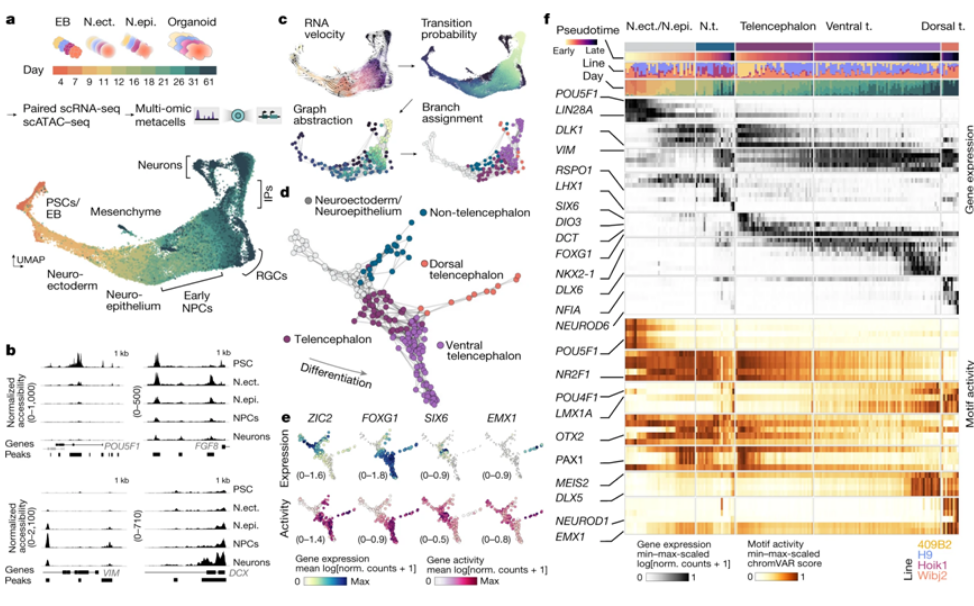
大脑类器官发育的多组学图谱揭示了发育的层次和命运决定的关键阶段。
图片来源:Nature, 2022, doi:10.1038/s41586-022-05279-8。
在一项新的研究中,Treutlein和她的同事们如今在不同的时间点和非常详细地研究了人类大脑类器官内的数千个细胞。他们的目标是用分子遗传学术语来描述这些细胞:换句话说,所有基因转录本(转录组)的总量作为基因表达的衡量标准,同时基因组可访问性作为调节活性的衡量标准。他们成功地将这些数据表示为一种图谱,用于显示这种大脑类器官内每个细胞的分子指纹。相关研究结果于2022年10月5日在线发表在Nature期刊上,论文标题为“Inferring and perturbing cell fate regulomes in human brain organoids”。
然而,这个过程产生了巨大的数据集:这种大脑类器官中的每个细胞有2万个基因,而每个大脑类器官又由成千上万个细胞组成。论文共同第一作者、Treutlein团队的博士生Jonas Fleck解释说,“这导致了一个巨大的矩阵,而我们能够解决它的唯一方法是借助合适的程序和机器学习。”为了分析所有这些数据并预测基因调节机制,这些作者开发了他们自己的程序。Fleck说,“我们可以用它来为每个基因生成一个完整的相互作用网络,并预测当该基因失效时在真实的细胞中会发生什么。”
doi:10.1038/s41586-022-05314-8
哺乳动物听觉和平衡感觉转导途径最初的步骤主要涉及将驱动力转化为机械感觉转导通道的门控机制。近日,一篇发表在国际杂志Nature上题为“Structure of C. elegans TMC-1 complex illuminates auditory mechanosensory transduction”的研究报告中,来自俄勒冈健康与科学大学等机构的科学家们通过研究首次以近原子的细节揭示了内耳中负责听觉的关键部分结构。
研究者Eric Gouaux说道:这是最后一个基本分子机制仍然未知的具体感觉系统,几十年来科学家们仍然无法详细描述执行这种绝对惊人过程的分子机制。目前,研究人员通过多年艰苦的研究解析了能使内耳将振动转化为声音的分子过程和结构,即所谓的机械感觉转导复合体。文章中,研究人员利用低温电镜技术揭示了该结构,相关研究结果或有望帮助开发新型疗法来治疗人类的听力损伤,如今听力损伤在全球影响着超过4.6亿人的健康,研究人员发现了内耳复合体的结构或能将振动转化为电脉冲,并由大脑转化为声音,这一过程 称之为机械感觉转导(mechanosensory transduction),其负责机体平衡和声音的感觉。
研究人员利用了这样一种事实,即秀丽隐杆线虫拥有一种与人类相似的机械感觉复合体,而解决基本结构是第一步。研究者Gouaux说道,其提出了有可能补偿这些缺陷的机制,如果一种突变能产生引起听力缺失的转导通道的缺陷,那么就有可能设计出一种适合该空间的分子,并挽救这种缺陷。或者其或许意味着我们能加强已经被削弱的相互作用。
【5】Nature:科学家对超过500万人的DNA进行研究揭示了与人类身高相关的遗传特征
doi:10.1038/s41586-022-05275-y
据推测,常见的单核苷酸多态性(SNPs)能共同解释40%-50%的人类身高的表型变异,但识别特定的突变体和相关的区域或许需要巨大的样本量。近日,一篇发表在国际杂志Nature上题为“A saturated map of common genetic variants associated with human height”的研究报告中,来自昆士兰大学等机构的科学家们进行了有史以来最大规模的基因组关联性研究,他们使用了来自281项研究中超过500多万人的DNA,揭示了与人类身高相关的遗传特征,这一研究填补了科学家们在理解遗传差异如何导致机体身高差异相关研究上的一大空白,本文研究中超过100万名参与者均为非欧洲后裔,即非洲、东亚、西班牙和南亚血统的后裔等。
研究者表示,他们发现了12111个突变体主要集中在与机体骨骼生长的基因组部位,其或能提供关于机体身高的强大遗传预测因素,而所识别出的突变体或能解释欧洲血统人群身高40%的差异,以及非欧洲血统人群身高10%-20%的差异。成人的身高主要由机体DNA所编码的信息来决定的,即来自高大父母的后代身高更高,而来自矮小父母的后代身高较矮,但这些评估或许并不完美。从一个小的婴儿成长为一个成年人,遗传因素在其中扮演着重要角色,而这一直是人类生物学领域中较为复杂且很难被理解的研究领域。此前,分析人类身高的最大规模的基因组关联性研究使用了高达70万名个体,而本文中的样本量是此前研究的7倍以上。
这项空前规模的研究或能为解释人类人类身高的高与矮提供了新的细节信息,遗传性因素与多个特定的基因组区域存在一定关联,有研究结果认为,与机体身高相关的遗传突变或许主要集中在覆盖基因组20%以上的区域中。本文研究或能帮助临床医生识别出那些无法达到遗传预测身高的人群,这可能有助于帮助诊断阻碍其生长或影响其机体健康的隐藏疾病或状况,此外,本文研究还提供了一张非常宝贵的蓝图来揭示如何利用基因组关联性研究来识别疾病的生物学特性,并确定随后的遗传组分。
【6】Nature:首次解析出IgM型B细胞抗原受体的三维结构图
doi:10.1038/s41586-022-05412-7
B细胞的表面覆盖着抗原受体,它们用这些受体识别入侵的病原体,如细菌和病毒。当B细胞抗原受体与外来抗原结合时,B细胞被激活并触发抗体的产生。抗体对我们的生存至关重要,并保护我们免受SARS-CoV-2等病原体感染引起的严重疾病。疫苗接种具有保护作用,因为它们激活了抗原受体,从而引发了免疫反应。在一项新的研究中,来自来自德国弗莱堡大学、美国哈佛医学院和波士顿儿童医院的研究人员公布了IgM型B细胞抗原受体的确切分子结构。他们的发现表明,B细胞表面的IgM型受体与其他受体相互作用,从而控制其信号转导。相关研究结果于2022年10月13日在线发表在Nature期刊上,论文标题为“Structural principles of B-cell antigen receptor assembly”。
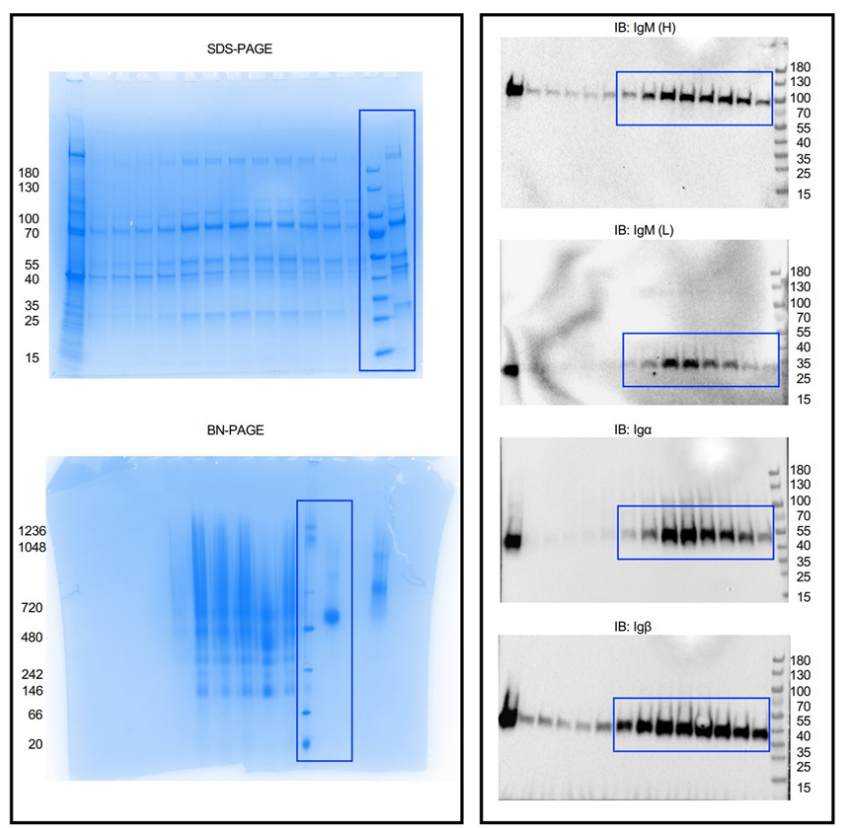
未经裁剪的SDS-PAGE凝胶和免疫印迹。
图片来源:Nature, 2022, doi:10.1038/s41586-022-05412-7。
B细胞抗原受体由一个结合在细胞膜上的免疫球蛋白(即膜结合抗体)和两个较小的亚基Igα和Igβ组成。一旦B细胞抗原受体识别出病原体,这些较小的亚基就会将信号传导到细胞内部,因而也称为信号传导亚基。论文共同通讯作者、弗莱堡大学生物系的Michael Reth教授说,“这些信号传导亚基究竟是如何与免疫球蛋白连接在一起的,这在以前是未知的。”Reth教授30多年来一直在研究B细胞抗原受体,并且最初发现了它的信号传导亚基。Reth说,“长期以来,我们没有技术上的可能性来研究膜蛋白的确切结构。如今,低温电子显微镜使我们能够解析出高分辨率的B细胞抗原受体的结构图。”
在低温电镜中,待研究的蛋白分子被非常迅速地冷却到零下183℃。这减少了它们的自然运动,防止了会破坏蛋白结构的微小冰晶形成。通过这种方式,有可能实现比其他电子显微镜方法高许多倍的分辨率。
【7】Nature:揭示线粒体DNA如何进入人类的细胞核基因组
doi:10.1038/s41586-022-05288-7
在一项新的研究中,来自英国剑桥大学和伦敦大学玛丽皇后学院的研究人员发现每4000个新生儿中就有一个人的线粒体中的一些遗传密码会插入到人类的细胞核DNA中,这为人类的进化提供了一个令人惊讶的新视角。他们还发现线粒体DNA也出现在一些癌症DNA中,这表明它就像膏药一样,试图修复人类遗传密码的损伤。相关研究结果于2022年10月5日在线发表在Nature期刊上,论文标题为“Nuclear-embedded mitochondrial DNA sequences in 66,083 human genomes”。
线粒体是位于我们细胞内的微小“细胞器”,它们在那里像电池一样,以ATP分子的形式提供能量,为细胞提供动力。每个线粒体都有自己的DNA---线粒体DNA,它与人类基因组的其他部分---细胞核DNA---不同。线粒体DNA是通过母系传递的,也就是说,我们从母亲而不是父亲那里遗传线粒体DNA。然而,2018年发表在PNAS上的一项研究中,来自美国辛辛那提儿童医院医疗中心的研究人员报告说,有证据表明一些线粒体DNA可通过父系传递(PNAS, 2018, doi:10.1073/pnas.1810946115)。
为了研究这一说法,剑桥大学的一个研究团队研究了Genomics England实验室的十万人基因组计划(100,000 Genomes Project)招募的11000多个家庭的DNA,寻找看起来像父系遗传的模式(Nature Communications, 2020, doi:10.1038/s41467-020-15336-3)。该团队在一些孩子的细胞核DNA中发现了线粒体DNA的“插入”,而这些插入的线粒体DNA在其父母的DNA中并不存在。这意味着辛辛那提儿童医院医疗中心的研究人员很可能得出了错误的结论:他们观察到的不是父系遗传的线粒体DNA,而是插入的线粒体DNA。如今,通过将2020年的那项研究工作扩展到66000多人,这些作者发现这些新插入的线粒体DNA实际上一直在发生,显示了我们基因组进化的一种新方式。
研究者Patrick Chinnery教授解释说,“几十亿年前,一个原始的动物细胞摄取了一个细菌,所摄取的细菌成为我们如今所说的线粒体。这些线粒体为细胞提供能量,使其能够正常运作,同时去除氧气,因为氧气在高浓度下是有毒的。随着时间的推移,这些原始线粒体的一部分已经进入细胞核,使得它们的基因组能够相互交谈。这一切被认为是在很久之前发生的,大多是在我们作为一个物种形成之前,但我们发现这不是真的。我们可以看到这种情况现在就在发生,我们的线粒体遗传密码以一种可衡量的方式转移到细胞核基因组中。”
【8】Nature:新研究确定了89个与中风风险相关的基因位点和6个有潜力作为中风药物靶点的基因
doi:10.1038/s41586-022-05165-3
在一项新的研究中,一个国际团队发现了89个与中风风险有关的基因位点和6个作为预防或治疗中风的潜在药物靶点的基因。在这89个基因位点中,有61个是新发现的。这些发现基于来自五个不同血统的250万人的数据,其中有20多万人发生过中风。GIGASTROKE联盟的成员进行了这项研究。相关研究结果于2022年9月30日在线发表在Nature期刊上,论文标题为“Stroke genetics informs drug discovery and risk prediction across ancestries”。
中风是全世界第二大死因,约占总死亡人数的12%,也是造成生命损失或残疾的主要因素。基因位点是基因在细胞内染色体上的物理位置。研究者Sudha Seshadri博士说,“这篇论文研究的人群具有相当的全球代表性,包括非洲、南亚、东亚、欧洲和拉美。有趣的是,其中一个群体仍然没有很好的代表性,就是美国的西班牙裔人口,所以仍有研究工作要开展。”
Seshadri说,中风是痴呆症的一个主要风险因素,而且这两种疾病之间存在着明显的重叠。中风会影响小血管、位于血管内壁的内皮细胞,以及对血管形成和其他功能很重要的称为周细胞(pericyte)的细胞。Seshadri说,血管性认知障碍和痴呆症也影响小血管、内皮细胞和周细胞。研究者Claudia Satizabal博士说,“中风和痴呆症之间有共同的生物学特性,这个项目中使用了研究中风遗传学的研究方法,这将使我们在研究痴呆症方面更加强大。”
【9】Nature:线粒体的形状在Th17细胞的免疫功能起着至关重要的作用
doi:10.1038/s41586-022-05264-1
免疫系统中的辅助性T 细胞17(T helper 17 cell, Th17)是一种CD4+T细胞,它们共同帮助制造抗体,激活吞噬敌人的细胞,并招募更多士兵到战场上。一项着重关注Th17细胞的新研究表明,它们的线粒体的形状和功能在诸如多发性硬化症之类的自身免疫和炎症性疾病中起着重要的作用,了解线粒体如何影响Th17细胞是了解如何控制它们的关键。他们确定了试图影响这些细胞行为的几个途径,目的是抑制它们的自身免疫活性。相关研究结果于2022年9月28日在线发表在Nature期刊上,论文标题为“An LKB1–mitochondria axis controls TH17 effector function”。
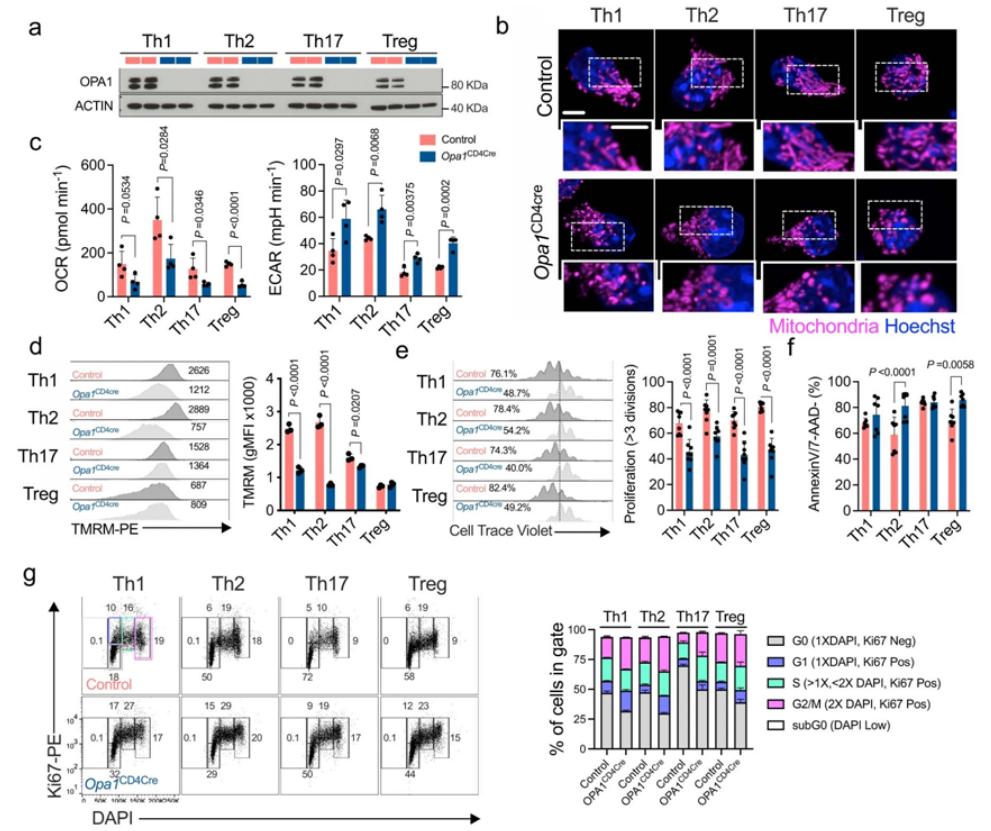
Opa1CD4Cre T细胞的线粒体功能障碍和增殖缺陷。
图片来源:Nature, 2022, doi:10.1038/s41586-022-05264-1。
当T细胞第一次接触到敌人时,它对来自敌人和环境的信号作出反应,成为几种类型的专门T细胞之一,每一种都在免疫反应中具有独特的功能。虽然所有的辅助性T细胞亚型对身体对抗外来入侵者至关重要,但它们的失衡也可能导致疾病,包括1型糖尿病、哮喘、过敏和慢性炎症。研究者Erika Pearce博士说,“如果我们能够控制T细胞,我们可以说是控制了许多(如果不是大多数)感染、自身免疫和癌症。”
这项新的研究开始于Pearce实验室的研究人员注意到Th17细胞的一个特有特征。在三种主要的效应T细胞类型(Th1、Th2和Th17)中,只有Th17细胞有拉长的线粒体;也就是说,它们的内部能量工厂被融合在一起,形成更大的结构。论文第一作者、德国马克斯-普朗克免疫生物学与表观遗传学研究所前博士后研究员Francesc Baixauli博士说,“这很奇怪,因为拉长的线粒体通常出现在静止的细胞中,而不是在激活的细胞中。”
【10】Nature:基于RNA的新型编辑工具CellREADR可精确编辑任何类型的细胞
doi:10.1038/s41586-022-05280-1
在一项新的研究中,来自美国杜克大学和冷泉港实验室的研究人员开发出一种基于RNA的编辑工具,它针对的是单个细胞,而不是基因。它能够精确靶向任何类型的细胞,并有选择地添加任何感兴趣的蛋白。该工具可能能够通过修改非常特定的细胞和细胞功能来控制疾病。相关研究结果于2022年10月5日在线发表在Nature期刊上,论文标题为“Programmable RNA sensing for cell monitoring and manipulation”。
在论文通讯作者、杜克大学神经生物学者Z. Josh Huang博士和论文第一作者、杜克大学博士后研究员Yongjun Qian博士的领导下,这些作者使用一种基于RNA的探针,证实他们可以在细胞中引入荧光标签,以标记特定类型的脑组织;一种光敏的开启/关闭开关,以沉默或激活他们选择的神经元;甚至一种自我摧毁酶,以精确清除一些细胞而不是其他细胞。
他们的选择性细胞监测和控制系统依赖于ADAR酶,这种酶存在于每种动物的细胞中。Huang说,虽然CellREADR(Cell access through RNA sensing by Endogenous ADAR, 通过内源性ADAR的RNA传感进行细胞访问)还处于早期阶段,但是潜在的应用似乎是无止境的,它有可能在整个动物界发挥作用。Huang说,“我们很兴奋,因为这提供了一种简化的、可扩展的和可普及的技术,以监测和操纵任何动物的所有细胞类型。我们实际上可以修改特定类型的细胞功能来控制疾病,而不考虑它们最初的遗传易感性。这在目前的治疗方法或药物中是不可能的。”(生物谷Bioon.com)
更多精彩阅读:
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


