IMMUNITY:抗原特异性CD4+T细胞的快速诱导与针对SARS-CoV-2mRNA疫苗接种的体液和细胞免疫协调相关
来源:生物谷 2021-09-15 16:16
COVID-19大流行对全球人类生活和社会经济福祉造成了深远的影响,促使预防性mRNA疫苗的紧急使用授权,最近的研究记录了疫苗接种后强烈的记忆B细胞和抗体反应可以中和SARS-CoV-2,包括人们关注的变体B.1.351(Beta,即贝塔变体)。
COVID-19大流行对全球人类生活和社会经济福祉造成了深远的影响,促使预防性mRNA疫苗的紧急使用授权,最近的研究记录了疫苗接种后强烈的记忆B细胞和抗体反应可以中和SARS-CoV-2,包括人们关注的变体B.1.351(Beta,即贝塔变体)。B细胞和抗体是免疫记忆的重要组成部分,抗体反应是大多数获得许可的疫苗保护的替代物,然而,在某些情况下由于遗传或治疗引起的B细胞缺陷而未能产生中和抗体的患者已从COVID-19中康复。此外,在血液系统恶性肿瘤患者中,CD8+T细胞似乎可以弥补体液免疫的缺乏并与改善的结果相关,表明T细胞在防止SARS-CoV-2感染方面发挥作用。

图片来源:https://doi.org/10.1016/j.immuni.2021.08.001
T细胞免疫在功能上是异质的,CD4+和CD8+T细胞的亚群有助于保护性免疫和长期免疫记忆,其中CD4+T滤泡辅助(Tfh)细胞在记忆B细胞、浆细胞和抗体的发育中起关键作用,而辅助性T淋巴细胞1(Th1)细胞支持并增强记忆CD8+T细胞反应的质量。此外,CD4+和CD8+T细胞的中枢记忆(CM)或效应记忆(EM)分化状态对持久性、再循环、组织通路和抗原再暴露后的反应具有影响,但在mRNA疫苗接种的背景下,对抗原特异性CD4+和CD8+T细胞的性质和分化状态知之甚少。因此,研究者试图解决这些问题并确定mRNA疫苗接种后疫苗诱导的CD4+和CD8+T细胞的动力学和分化状态,以及评估了mRNA疫苗接种如何形成抗原特异性适应性免疫。
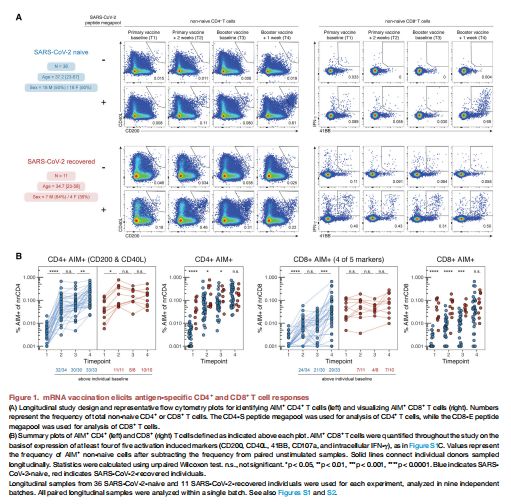
mRNA疫苗接种引发抗原特异性CD4+和CD8+T细胞反应 图片来源:https://doi.org/10.1016/j.immuni.2021.08.001
该研究在四个关键时间点获得外周血单个核细胞(PBMC):接种前基线(时间点1)、初次接种后2周(时间点2)、加强接种当天(时间点3)和加强接种后1周(时间点4),然后利用流式细胞术评估了肽依赖性激活诱导标记(AIM)表达与未受刺激的对照样品相比。AIM+CD4+T细胞定义为白细胞分化抗原200(CD200)和白细胞分化抗原40配体(CD40L)的双重表达,尽管干扰素γ(IFNγ)和肿瘤坏死因子受体超家族成员9(41BB)的双重表达对于可视化AIM+CD8+T细胞群很有用,但由于基线信号高,单独的双标记策略对于检测疫苗引发的反应是次优的。
分析结果表明,大多数SARS-CoV-2康复的捐赠者在基线时具有明显可检测的抗原特异性CD4+和CD8+T细胞群,相比之下,在许多未感染SARS-CoV-2的个体中检测不到疫苗接种前对肽刺激的反应,尽管一些受试者确实具有低频率的疫苗接种前AIM+T细胞,这可能归因于先前季节性冠状病毒感染的交叉反应细胞。SARS-CoV-2S特异性CD4+T细胞在未感染SARS-CoV-2和第一剂mRNA疫苗后恢复的个体中被强力激发,所有参与者对第一剂产生可检测的反应,在第二次接种疫苗后,未感染SARS-CoV-2的个体(而非康复个体)接受了额外的抗原特异性CD4+T细胞增强。
mRNA接种诱导抗原特异性记忆T细胞,镜像记忆T细胞对自然感染的反应 图片来源:https://doi.org/10.1016/j.immuni.2021.08.001
研究者接下来试图定义疫苗诱导的AIM+T细胞的分化状态,使用白细胞共同抗原RA(CD45RA)、肿瘤坏死因子受体超家族7(CD27)和趋化因子受体7(CCR7)检查了中枢和效应记忆群体的亚群,使用这些标记定义了乳糜微粒(CM)、记忆效应类型1、2和3(EM1, EM2, EM3)以及终末分化效应记忆(EMRA)细胞。SARS-CoV-2康复个体的基线AIM+CD4+T细胞反应大概是在先前的SARS-CoV-2感染期间产生的,主要由EM1(CD45RA-CD27+CCR7-)和CM细胞组成,在接种疫苗后这些SARS-CoV-2特异性CD4+T细胞的记忆T细胞亚群分布没有显著变化,而在未感染SARS-CoV-2的个体中,第一剂疫苗主要诱导EM1和CM亚群中的AIM+CD4+T细胞,类似于恢复供体的反应。研究者发现,AIM+CD8+T细胞的亚群分布与AIM+CD4+T细胞相似,康复受试者的基线抗原特异性CD8+T细胞反应由相似比例的EM1、CM和终末分化的 CD8+EMRA (CD45RA+ CD27−CCR7−)T细胞组成。
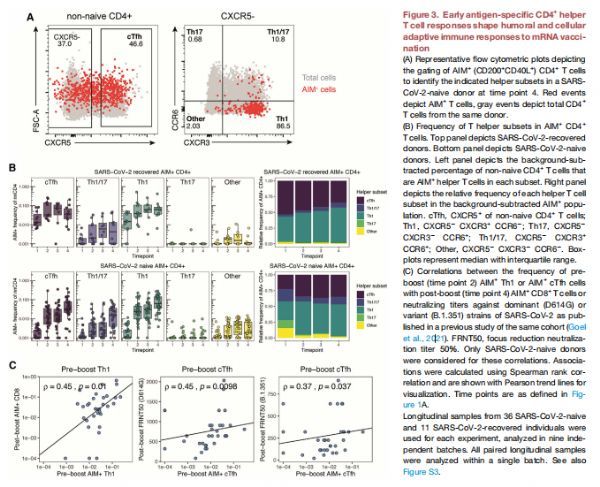
早期抗原特异性CD4+辅助T细胞反应形成对mRNA疫苗接种的体液和细胞适应性免疫反 图片来源:https://doi.org/10.1016/j.immuni.2021.08.001
鉴于辅助T细胞亚群(如CD4+Tfh细胞)在帮助B细胞反应方面的作用以及辅助性T淋巴细胞1(Th1)在病毒感染中的重要性,研究者接下来探索了AIM+CD4+T细胞的分化状态发现,康复个体的基线AIM+CD4+T细胞反应以循环滤泡辅助性T细胞(cTfh)和Th1细胞为主,在未感染SARS-CoV-2的受试者中,第一剂疫苗也主要引起抗原特异性Th1和cTfh细胞,这种分布是通过在未感染SARS-CoV-2的个体中进行加强疫苗接种而维持的,这些AIM+亚群通过第二剂疫苗进一步加强。此外,研究者观察到在未感染SARS-CoV-2的个体中,增强前AIM+Th1 细胞的频率与增强后AIM+CD8+T细胞的频率之间存在很强的相关性,这与初次接种产生的Th1细胞在加强接种后增强CD8+T细胞反应中的作用一致。
尽管根据该研究的分析优化,用于分离记忆T细胞和辅助T细胞亚群的分化标记在AIM分析的时间范围内似乎保持稳定,但刺激后的细微变化可能会影响精确的分化状态分配,因此,在未来的研究中执行表位作图和使用I类和II类白细胞抗原四聚体在没有刺激的情况下检查抗原特异性细胞将是有益的。(生物谷 bioon)
参考文献
Mark M. Painter et al. Rapid induction of antigen-specific CD4+ T cells is associated with coordinated humoral and cellular immunity to SARS-CoV-2 mRNA vaccination. IMMUNITY (2021 Aug 13) doi:https://doi.org/10.1016/j.immuni.2021.08.001
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。