Neurosci Bull新发现!携带SCN2A突变的人脑类器官模型揭示癫痫超兴奋性,卡马西平或成精准治疗新选择
来源:生物谷原创 2025-06-26 14:17
本研究构建携带新型SCN2A突变(p.E512K)的人皮层类器官,发现其具神经元超兴奋性,对卡马西平等抗癫痫药反应各异,证实该类器官可作药物临床前评估平台。
在神经内科门诊,医生常常面临这样的困境:同样是癫痫患者,携带离子通道基因突变的个体对药物的反应却大相径庭。作为神经系统疾病领域的重要研究方向,遗传癫痫尤其是通道病相关癫痫的精准治疗一直是临床难题。
近日,Neurosci Bull的一项研究Human Cortical Organoids with a Novel SCN2A Variant Exhibit Hyperexcitability and Differential Responses to Anti-Seizure Compounds为这一困境提供了新的解决思路——研究团队利用患者来源的新型SCN2A突变(p.E512K)构建了皮层类器官模型,不仅揭示了神经元超兴奋性的电生理机制,更首次证明这类个体化类器官可作为抗癫痫药物临床前评估的高效平台。

研究背景与关键发现
电压门控钠离子通道(VGSCs)基因变异是遗传癫痫的主要致病因素,其中SCN2A编码的Nav1.2通道在神经发育早期至成熟期均发挥关键作用。既往研究表明,SCN2A突变可通过功能获得(GoF)或功能丧失(LoF)两种机制引发癫痫,但由于异源细胞模型与真实神经元环境的差异,部分突变的功能表型仍存在争议。
本研究首先在HEK293T细胞中验证了新型突变p.E512K的电生理特性:与野生型相比,突变型Nav1.2通道的钠电流密度显著增加(野生型-73.6±14.8 pA/pF vs 突变型-120.6±18.5 pA/pF,P<0.0001),且激活电压阈值显著左移(半激活电压从-13.8±1.4 mV降至-24.3±1.7 mV),提示该突变通过GoF机制增强通道活性。值得注意的是,稳态失活曲线未出现显著变化,但突变型通道的窗口电流范围明显拓宽,这可能是导致神经元持续去极化的关键因素。
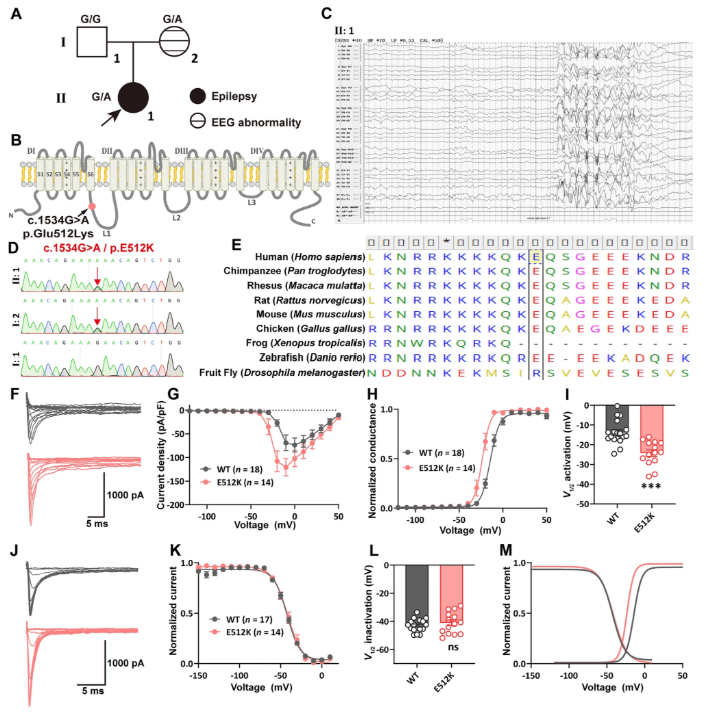
图 1:SCN2A E512K变异的鉴定与表征
类器官模型构建
为更贴近生理环境研究突变效应,研究团队利用患者皮肤成纤维细胞重编程获得诱导多能干细胞(iPSCs),并通过CRISPR-Cas9技术构建了等基因对照细胞系。免疫荧光染色显示,患者来源的皮层类器官(COs)在神经发育标志物(PAX6、SOX2、NeuN等)表达及皮层分层(SATB2、CTIP2、BRN2)方面与健康对照无显著差异,表明SCN2A p.E512K突变不影响早期神经发育。
多电极阵列(MEA)记录揭示了关键的功能异常:与对照组相比,患者COs的活跃电极数量显著增多(健康对照2.3±0.7 vs 患者14.4±1.3,P<0.0001),放电频率提升近7倍(1.5±0.6 Hz vs 9.9±1.2 Hz),且出现特征性的网络爆发放电(Network Burst)。同步化指数分析进一步证实,突变导致神经元网络同步性异常增高(0.0043±0.0016 vs 0.1155±0.0323),这些电生理特征与患者临床EEG表现高度吻合,首次在体外模型中重现了通道病相关癫痫的网络异常。
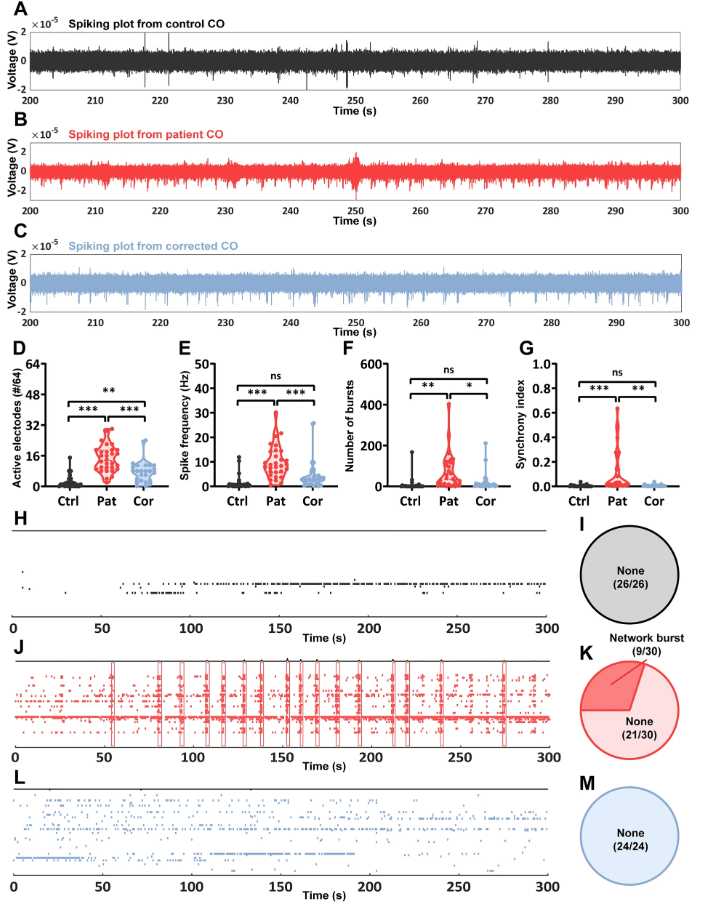
图 2:患者来源皮层类器官的神经元和网络兴奋性
药物筛选新范式
基于类器官模型的病理表型,研究团队开展了抗癫痫药物(ASMs)的反应性测试。选择卡马西平(CBZ,钠离子通道阻滞剂)、丙戊酸(VPA,广谱抗癫痫药)、吡仑帕奈(PER,AMPA受体拮抗剂)和GABA(抑制性神经递质)进行剂量依赖性评估,结果显示:
CBZ表现出最强的抑制效应,300 μmol/L浓度即可使放电频率降低97.2%,且呈严格的剂量相关性;GABA在100 μmol/L时抑制率达94.1%,但高浓度(3000 μmol/L)时效果饱和;VPA虽也呈现剂量依赖抑制(10000 μmol/L时抑制96.3%),但低浓度下效果较弱(100 μmol/L仅抑制28.7%);PER的抑制效应最不稳定,10 μmol/L时可达89.9%,但30 μmol/L时反而降至73.8%,提示其可能存在复杂的浓度-效应关系。
这一结果与突变的GoF特性高度一致:作为Nav1.2通道特异性阻滞剂,CBZ能有效阻断突变导致的钠电流增强,而VPA等非特异性药物效果相对有限。值得关注的是,患者临床目前使用VPA联合左乙拉西坦治疗,虽达到无发作,但EEG仍显示左颞区异常放电,这与类器官模型中VPA单药效果不佳的结果相互印证,为临床用药调整提供了重要参考。
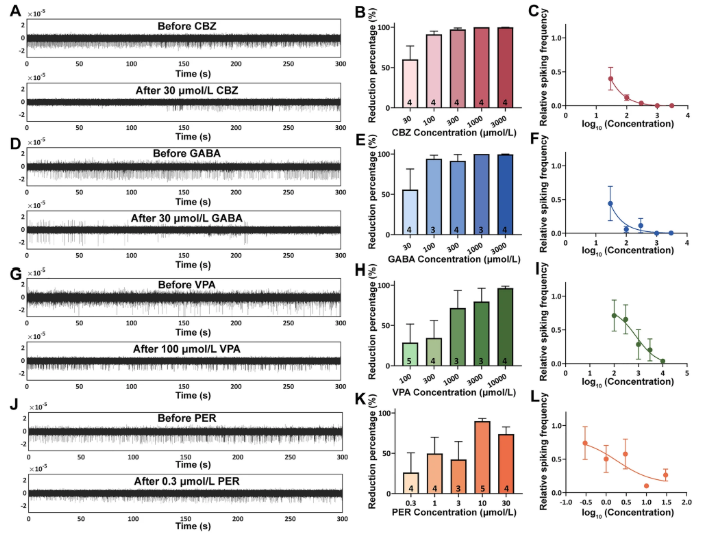
图 3:患者来源类器官对抗癫痫药物的反应
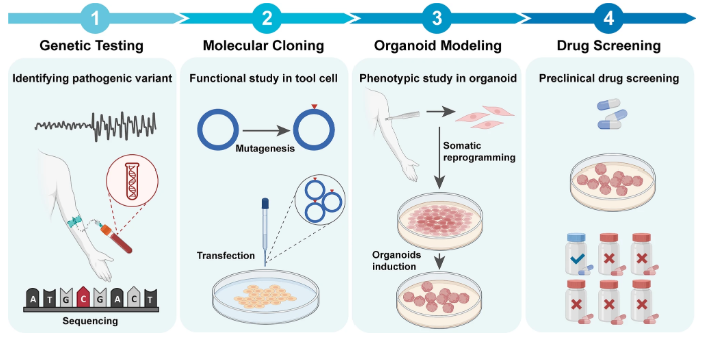
图 4:通道病相关癫痫药物筛选的工作流程
研究意义与转化前景
这项研究首次将患者特异性类器官模型应用于通道病相关癫痫的药物筛选,建立了“基因突变-电生理表型-药物反应”的完整研究链条。与传统异源细胞模型相比,类器官模型不仅保留了神经元网络的复杂性,还能反映遗传背景对突变效应的修饰作用——如等基因对照组的放电频率仍高于健康对照,提示遗传背景中的其他变异可能参与了疾病表型的调控。
从临床转化角度看,这种个体化类器官平台为“精准抗癫痫治疗”提供了全新路径:通过患者来源的类器官进行药物反应性预测,有望避免临床试药的盲目性,尤其是对SCN2A等基因型-表型关系复杂的通道病。尽管目前类器官模型仍存在细胞类型单一、成熟度有限等挑战,但该研究已为神经系统遗传病的机制研究与药物开发开辟了新的技术路线。
随着再生医学与电生理检测技术的进步,我们有理由期待,这种结合患者特异性类器官与多电极阵列的“体外癫痫模型”将逐步从实验室走向临床,成为指导抗癫痫药物选择的重要工具,为更多难治性癫痫患者带来精准治疗的新希望。(生物谷Bioon.com)
参考文献:
Yang Y, Cai Y, Wang S, et al. Human Cortical Organoids with a Novel SCN2A Variant Exhibit Hyperexcitability and Differential Responses to Anti-Seizure Compounds. Neurosci Bull. Published online June 20, 2025. doi:10.1007/s12264-025-01429-w
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


