Nature子刊:我国学者发现泛冠状病毒广谱中和抗体新机制
来源:生物世界 2022-07-06 09:21
该研究发现的单抗具有更宽的广谱中和活性,同时具有全新的中和机制。
中科院分子细胞科学卓越创新中心、复旦大学上海医学院及上海市公共卫生临床中心合作,孙兵研究员、谢幼华研究员、徐建青研究员、陆路研究员、丁建平研究员与凌志洋副研究员领衔,在 Nature Microbiology 期刊在线发表了题为:Neutralization mechanism of a human antibody with pan-coronavirus reactivity including SARS-CoV-2 的研究论文。
该研究发现了一株泛冠状病毒广谱全人中和抗体——76E1,其不仅能有效地中和 beta 冠状病毒属的 SARS-CoV-2 及其重要突变体毒株,还可以中和不同冠状病毒属的七种人类冠状病毒。
该抗体靶向冠状病毒表面刺突蛋白(Spike, S)上高度保守的 S2’ 酶切位点及融合肽区域。病毒结合受体 ACE2 过程促进该表位的暴露以及 76E1 抗体结合,进而抑制 S2’ 酶切及病毒包膜和宿主胞膜的膜融合,从而抑制病毒进入宿主细胞内,达到中和病毒的目的。

冠状病毒分为 alpha、beta、gamma 和 delta 四个属。21世纪共爆发了三次高致病性人类冠状病毒流行,分别为 SARS-CoV、MERS-CoV 和 SARS-CoV-2,均归类于 beta 属。
除此之外,几种普通型冠状病毒也时常在人群中流行,导致无症状或轻型上呼吸道感染疾病,如 alpha 属的HCoV-229E 和 HCoV-NL63,beta 属的 HCoV-OC43 和 HCoV-HKU1。
2019年底爆发的 SARS-CoV-2 大流行对全球经济社会和人类健康造成重大威胁,SARS-CoV-2 突变株的不断出现及广泛传播也引起世界范围内的多轮流行。我国乃至全球已经接种的疫苗均基于 SARS-CoV-2 原始株开发,而突变体毒株已经逐渐对 SARS-CoV-2 原始株疫苗建立的免疫屏障产生了一定程度的逃逸作用,尤其是 Omicron 突变体所产生的免疫逃逸现象非常明显。因此,如何有效的应对 SARS-CoV-2 突变是目前应对疫情最紧迫的任务。另外,人类依然要面对未来爆发新的冠状病毒大流行的可能性。因此,开发有效的广谱抗冠状病毒的疫苗和药物有重大的社会需求。
大量的临床实践已证明,单克隆抗体临床干预在预防和治疗病毒感染方面非常有效。虽然国内及国际上已有新冠单克隆抗体药物上市,然而大部分已经对 Omicron 等变异株失效或疗效显著降低。
针对不断出现的病毒突变株,一个亟待回答的科学问题是:是否能开发广谱中和SARS-CoV-2及其突变体的抗体?这种抗体亦能对不同冠状病毒属的人类冠状病毒有广谱中和作用?其广谱作用的机制是什么?
为了解决上述科学问题,研究者们首先用 SARS-CoV-2 S 胞外区蛋白作为诱饵,从新冠病毒感染的康复患者外周血 PBMC 中,分离了 S 蛋白特异性的记忆 B 细胞,通过基因工程技术获得单个记忆 B 细胞来源的抗体重、轻链基因,并表达制备成全人源抗体。通过 ELISA 结合实验和病毒中和实验,筛选到一株广谱中和抗体——76E1,其可以广谱结合并中和 SARS-CoV-2 及其突变体毒株,包括 Alpha、Beta、Kappa、Gamma、Delta 和 Omicron。
在 hACE2 转基因小鼠上的真病毒攻击实验表明,用 76E1 单抗预防和治疗 SARS-CoV-2 感染时,可显著减少体重下降和降低肺部病毒滴度。进一步,研究人员发现 76E1 单抗可以广谱结合并中和不同冠状病毒属的七种人类冠状病毒,包括 SARS-CoV、MERS-CoV、SARS-CoV-2、HCoV-229E、HCoV-OC43、HCoV-NL63 及 HCoV-HKU1。在乳鼠上进行的 76E1 预防和治疗 HCoV-OC43 真病毒感染实验表明,76E1 可以可显著减少体重下降和降低脑部病毒滴度。以上实验提示该抗体有潜在的临床应用价值。
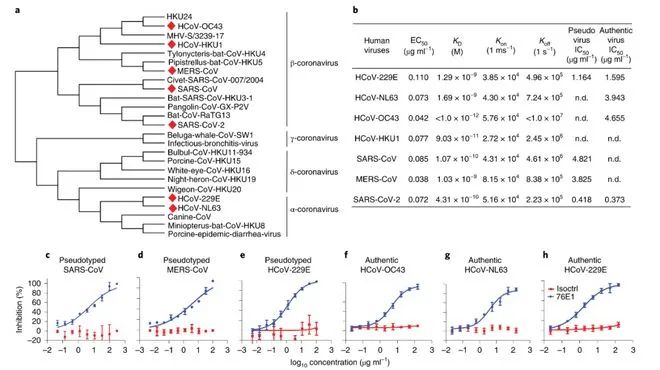
76E1在细胞水平对多种冠状病毒表现泛中和活性
为了进一步研究 76E1 单抗广谱中和冠状病毒的分子机制,研究人员解析了 76E1 Fab/抗原多肽的晶体结构,发现 76E1 单抗主要靶向 S 蛋白的 S2' 酶切位点和融合肽区域。丙氨酸突变实验进一步确认 R815、E819、D820、L822、F823、K825 是 76E1 的关键识别表位。序列比对发现,以上表位在四种冠状病毒属中高度保守,这是 76E1 广谱中和能力的分子基础。比较有意思的是,76E1 的关键识别表位在融合前三聚体 S 蛋白全部或部分隐藏。并且,76E1 Fab/ 抗原多肽晶体结构中的抗原多肽与融合前三聚体 S 蛋白中的相应多肽也展现出不一样的构象。同时,亲和力实验表明 76E1 难以识别融合前三聚体 S 蛋白,而 RBD 抗体却能很好的结合融合前三聚体 S 蛋白。以上提示 76E1 可能识别了三聚体 S 蛋白从融合前到融合后变构过程中的中间态构象。
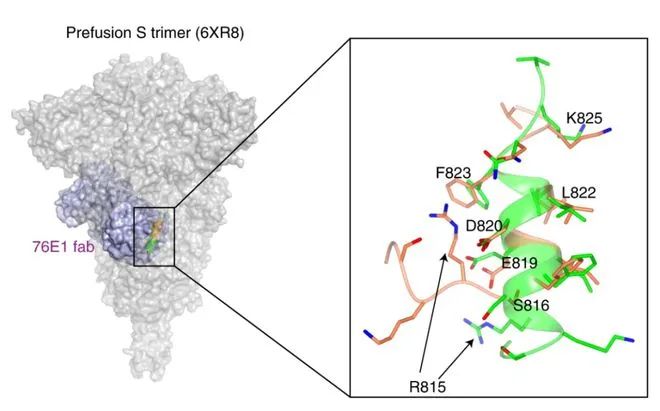
76E1和刺突蛋白三聚体结合机制
随后,研究者发现 S 蛋白结合受体 ACE2 过程促进了 S2' 酶切位点和融合肽的暴露,进而 76E1 结合该表位,从而抑制 S2' 酶切,阻断病毒包膜与宿主胞膜的膜融合过程,最终抑制病毒进入宿主细胞,中和病毒。冠状病毒利用这一策略来掩盖它们的融合过程中的敏感位点,从而限制抗体接触到这种敏感位点,并且仅在识别和感染宿主细胞时才将它暴露出来。
进一步的研究表明,76E1 在病毒感染后期具有很大的优势性,即在病毒结合宿主细胞受体后,阻断受体结合过程的 RBD 抗体失去中和活性,而 76E1依然可以中和病毒。利用以上原理,研究者发现 ACE2 蛋白与 76E1 单抗具有协同中和 SARS-CoV-2 的效果。同时,发现一些具有模仿 ACE2 功能的 RBD 抗体,如 CB6 等,与 76E1 也具有协同中和 SARS-CoV-2 的效果。这为基于抗体的抗病毒疗法提供新的升级版策略。
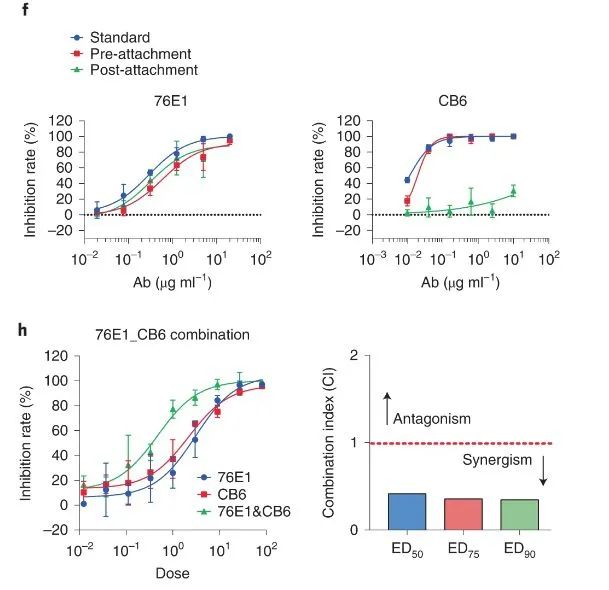
76E1和CB6抗病毒协同作用
综上所述,该研究发现的单抗具有更宽的广谱中和活性,同时具有全新的中和机制。为应对 SARS-CoV-2 突变及未来新发冠状病毒爆发提供新的抗病毒策略,同时为新一代广谱冠状病毒疫苗的设计提供重要参考和理论依据。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


